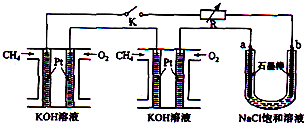
题目内容
17.常温下,向水中加入了盐酸溶液,由水电离产生的c(H+)=1×10-9mol/L 时,溶液的pH=5.分析 常温下,水的离子积为1×10-14,向水中加入了盐酸溶液后,氢离子抑制了水的电离,溶液中的氢氧根离子是水电离的,则由水电离产生的c(H+)=1×10-9mol/L,即此时溶液中的氢氧根离子浓度为1×10-9mol/L,然后结合水的离子积计算出溶液中氢离子浓度,再根据pH=-lgc(H+)计算出该溶液的pH.
解答 解:常温下,向水中加入了盐酸溶液后,盐酸中的氢离子抑制了水的电离,溶液中的氢氧根离子是水电离的,
则由水电离产生的c(H+)=1×10-9mol/L,即此时溶液中的氢氧根离子浓度为:c(OH-)=1×10-9mol/L,
常温下,水的离子积为1×10-14,则此时溶液中氢离子浓度为:$\frac{1×1{0}^{-14}}{1×1{0}^{-9}}$mol/L=1×10-5mol/L
该溶液中溶液的pH=-lgc(H+)=5,
故答案为:5.
点评 本题考查了溶液pH的计算,题目难度中等,明确向水中加入了盐酸溶液后,溶液中的氢氧根离子是水电离的为解答关键,注意掌握溶液酸碱性与溶液pH的关系.

练习册系列答案
相关题目
7.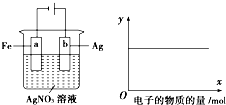 按图实验,若x轴表示流入阴极电子的物质的量,则y轴可表示①c(Ag+) ②c(NO3-)③a棒的质量④b棒的质量( )
按图实验,若x轴表示流入阴极电子的物质的量,则y轴可表示①c(Ag+) ②c(NO3-)③a棒的质量④b棒的质量( )
 按图实验,若x轴表示流入阴极电子的物质的量,则y轴可表示①c(Ag+) ②c(NO3-)③a棒的质量④b棒的质量( )
按图实验,若x轴表示流入阴极电子的物质的量,则y轴可表示①c(Ag+) ②c(NO3-)③a棒的质量④b棒的质量( )| A. | ①③ | B. | ③④ | C. | ①②④ | D. | ①② |
2.下列实验方案的设计、结论正确的是( )
| A. | 用 NaHCO3 溶液可一次鉴别出稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2 溶液 | |
| B. | 高锰酸钾试剂瓶内壁上黑色物质可用稀盐酸洗涤 | |
| C. | 除去SO2 中少量HCl,将其通入饱和的Na2SO3 溶液 | |
| D. | 将硝酸铵晶体溶于水,测得水温下降,证明硝酸铵水解是吸热的 |
17.从溴乙烷制取1.2-二溴乙烷,下列转化方案中最好的是( )
| A. | CH3CH2Br$\stackrel{NaOH水溶液}{→}$CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2=CH2$\stackrel{HBr}{→}$CH2BrCH3$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br |
18.某种发动机燃料由A、B两种物质混合而成,A、B两种物质含有C、H、O三种元素中的两种或三种.已知常温下,A、B及CO、H2的燃烧热如下:
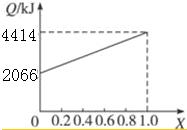
A、B按不同比例混合的燃料91.2 g,在足量的氧气中燃烧时,放出的热量Q与B的物质的量分数x的关系如上图.
(1)A、B的相对分子质量为A32,B114.
(2)等物质的量的A、B混合的燃料73 g,在160L O2中完全燃烧,反应后气体通过浓硫酸后,得到104L气体,通过碱石灰吸收后剩余3.2 L(气体体积均在标准状况下测定).由此可推得混合物中N(C):N(H):N(O)=9:22:1,A分子式为CH4O,B分子式为C8H18.
(3)1 mol等物质的量的A、B混合的燃料,在一定量的氧气中燃烧,放出热量2980 kJ,则反应中生成CO0.5
mol.
| 物质 | A | B | CO | H2 |
| 燃烧热/kJ•mol-1 | 725 | 5 518 | 283 | 286 |

A、B按不同比例混合的燃料91.2 g,在足量的氧气中燃烧时,放出的热量Q与B的物质的量分数x的关系如上图.
(1)A、B的相对分子质量为A32,B114.
(2)等物质的量的A、B混合的燃料73 g,在160L O2中完全燃烧,反应后气体通过浓硫酸后,得到104L气体,通过碱石灰吸收后剩余3.2 L(气体体积均在标准状况下测定).由此可推得混合物中N(C):N(H):N(O)=9:22:1,A分子式为CH4O,B分子式为C8H18.
(3)1 mol等物质的量的A、B混合的燃料,在一定量的氧气中燃烧,放出热量2980 kJ,则反应中生成CO0.5
mol.
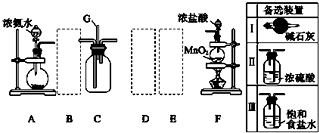 .
.