题目内容
13.某化学实验小组同学利用图1装置制备氨气,并探究氨气的性质.请回答:(1)实验室制备氨气的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaCl2;
(2)装置B中烧杯滴加酚酞溶液,并打开止水夹,观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是氨气极易溶于水,溶于水显碱性.
(3)写出氨气与水反应的化学方程式NH3+H2O?NH3•H2O?NH4++OH-.
(4)为防止污染空气,图2装置可用于吸收多余氨气的是ABD.

分析 (1)氯化铵和氢氧化钙固体加热制取氨气;
(2)根据氨气的喷泉实验原理回答,滴有酚酞的溶液变红,溶液显示碱性;
(3)氨气溶于水生成一水合氨;
(4)选择的装置必须能够防止倒吸.
解答 解:(1)实验室制取氨气是用氯化铵和氢氧化钙固体加热生成氨气和氯化钙、水,其化学方程式是:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
(2)氨气极易溶于水,可以完成喷泉实验,氨水是弱碱,能够电离出氢氧根离子,致使酚酞溶液显红色,故答案为:红色喷泉;氨气极易溶于水;溶于水显碱性;
(3)氨气溶于水生成一水合氨,一水合氨电离生成铵根和氢氧根,化学反应方程式为:NH3+H2O?NH3•H2O?NH4++OH-,故答案为:NH3+H2O?NH3•H2O?NH4++OH-;
(4)因为氨气极易溶于水,吸收多于的氨气装置,必须能够防止倒吸,AD装置中的倒置的漏斗和球形干燥管的体积较大,能防止液体倒吸进入反应装置,
B装置中四氯化碳可以减慢氨气溶于水的速率,故答案为:ABD.
点评 本题考查了氨气的制取和性质检验,涉及了实验装置的选择、化学方程式的书写,本题难度不大.

练习册系列答案
相关题目
3.下列反应符合图示的是( )
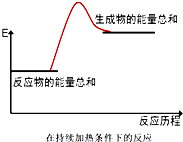

| A. | 酸碱中和反应 | B. | Ba(OH)2•8H2O与NH4Cl晶体的反应 | ||
| C. | 合成氨的反应 | D. | 碳酸钙的分解反应 |
4.下列含硫化合物中,硫元素既有氧化性又有还原性的是( )
| A. | S | B. | H2S | C. | SO2 | D. | SO3 |
1.4NH3+5O2≒4NO+6H2O反应在5L的密闭容器中进行,半分钟后,NO物质的量增加了0.3mol,则此反应的反应速率为( )
| A. | V(O2)=0.01mol/L•s | B. | V(NO)=0.008mol/L•s | ||
| C. | V(H2O)=0.003mol/L•min | D. | V(NH3)=0.002mol/L•s |
18.用下列气体和溶液进行喷泉实验,最终液体不能充满烧瓶的是( )
| A. | CO2和NaOH溶液 | B. | NO2和水 | C. | NH3和水 | D. | Cl2和NaOH溶液 |
2.下列实验方案的设计、结论正确的是( )
| A. | 用 NaHCO3 溶液可一次鉴别出稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2 溶液 | |
| B. | 高锰酸钾试剂瓶内壁上黑色物质可用稀盐酸洗涤 | |
| C. | 除去SO2 中少量HCl,将其通入饱和的Na2SO3 溶液 | |
| D. | 将硝酸铵晶体溶于水,测得水温下降,证明硝酸铵水解是吸热的 |
14.物质的量相同的下列有机物,充分燃烧耗氧量最大的是( )
| A. | C2H2 | B. | C2H6O | C. | C4H6 | D. | C2H4 |
 .
.