题目内容
6.下列关于元素周期表和元素周期律的说法不正确的是( )| A. | 从氟到碘,其氢化物的稳定性逐渐减弱 | |
| B. | 氧与硫为同主族元素,氧比硫的原子半径小,氧比硫的非金属性强 | |
| C. | 第三周期从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 | |
| D. | 因为铝原子比钠原子失去电子数目多,所以铝比钠的还原性强 |
分析 A.元素非金属性越强,其氢化物的稳定性越强;
B.原子电子层数越多其原子半径越大,同一主族元素,元素非金属性随着原子序数增大而减弱;
C.同一周期元素,元素金属性随着原子序数增大而减弱、非金属性随着原子序数增大而增强,元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.金属原子越易失电子,则其还原性越强.
解答 解:A.元素非金属性越强,其氢化物的稳定性越强,非金属性F>Cl>Br>I,所以从氟到碘,其氢化物的稳定性逐渐减弱,故A正确;
B.原子电子层数越多其原子半径越大,同一主族元素,元素非金属性随着原子序数增大而减弱,O和S位于同一主族且S原子序数大于O,所以氧比硫的原子半径小,氧比硫的非金属性强,故B正确;
C.同一周期元素,元素金属性随着原子序数增大而减弱、非金属性随着原子序数增大而增强,元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以第三周期从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强,故C正确;
D.金属原子越易失电子,则其还原性越强,Na比Al易失电子,所以还原性Na>Al,故D错误;
故选D.
点评 本题考查元素周期表和元素周期律的综合应用,侧重考查基础知识运用,明确元素周期律内涵是解本题关键,易错选项是D,注意金属性强弱与失电子难易程度有关,与失电子多少无关.

练习册系列答案
相关题目
9.直接排放含SO2的烟气会形成酸雨,危害环境.可利用氢氧化钠溶液脱除烟气中的SO2.
(1)当用含NaOH物质的量为3mol的溶液,吸收标准状况下44.8L SO2时,溶液中的溶质为Na2SO3、NaHSO3.
(2)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
①由上表判断,NaHSO3溶液显酸性性,用化学用语结合简单文字解释:HSO3-=H++SO32-、HSO3-+H2O=H2SO3+OH-,因为HSO3-电离大于水解,所以显酸性
②NaHSO3溶液中所含离子的浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
③当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(1)当用含NaOH物质的量为3mol的溶液,吸收标准状况下44.8L SO2时,溶液中的溶质为Na2SO3、NaHSO3.
(2)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②NaHSO3溶液中所含离子的浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
③当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
10.下列关于化学键的说法正确的是( )
| A. | 阴、阳离子之间通过相互吸引作用形成的化学键叫离子键 | |
| B. | 根据电离方程式HCl=H++Cl-,可判断HC1分子里存在离子键 | |
| C. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| D. | 离子化合物一定由金属元素和非金属元素组成 |
7.按如图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)( )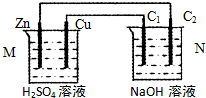

| A. | 工作一段时间后装置M、N中溶液pH均增大 | |
| B. | M装置中H+移向Zn电极 | |
| C. | C2上发生氧化反应 | |
| D. | Cu电极与C1电极发生的电极反应相同 |
18.下列原因解释与氢键无关的( )
| A. | CH4的沸点比SiH4低,而CH4比SiH4热稳定性强 | |
| B. | 有机物大多难溶于水,而乙醇和乙酸可与水互溶 | |
| C. | H2O2和H2S的相对分子相近,而H2O2的沸点远高于H2S | |
| D. | 采用加压液化的方法从氨合成塔里分离出NH3 |
16.乙烯酮(CH2=C=O)在一定条件下能与含活泼氢的化合物发生加成反应,反应可表 .乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是( )
.乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是( )
 .乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是( )
.乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是( )| A. | 与CH3OH加成生成CH3CH2COOH | B. | 与H2O加成生成CH3COOH | ||
| C. | 与CH3COOH加成生成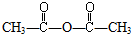 | D. | 与HCl加成生成CH3COCl |

 .
.
 .
. .
.