题目内容
9.现有NH4Cl和氨水组成的混合液:(1)若溶液中pH=7,则该溶液中[NH4+]=[Cl-](填“>”“<”或“=”.下同).
(2)若溶液中pH>7,则该溶液中[NH4+]>[Cl-].
(3)若[NH4+]<[Cl-],则溶液的pH<7.
分析 (1)常温下,pH=7的溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒判断c(NH4+)、c(Cl-)相对大小;
(2)若溶液的pH>7,则c(H+)<c(OH-),根据电荷守恒可知[NH4+]>[Cl-];
(3)若[NH4+]<[Cl-],根据电荷守恒可知:c(H+)>c(OH-).
解答 解:(1)常温下,pH=7的溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(NH4+)+c(H+)=c(OH-)+c(Cl-),所以c(NH4+)=c(Cl-),
故答案为:=;
(2)若溶液的pH>7,如为碱性,则:c(H+)<c(OH-),根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可得:[NH4+]>[Cl-],
故答案为:>;
(3)若[NH4+]<[Cl-],根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可得:c(H+)>c(OH-),溶液呈酸性,则溶液的pH<7,
故答案为:<.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒的含义及盐的水解原理为解答关键,注意掌握判断溶液中离子浓度大小常用方法.

练习册系列答案
相关题目
19.如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )

| A. | a为负极,c为阴极发生氧化反应 | |
| B. | 电子从电源的负极沿导线流入电解池的阴极 | |
| C. | 电解过程中,d电极:2Cl--2e-═Cl2↑ | |
| D. | 若反应过程中,有2.24 L 气体产生,则有0.2 mol电子发生转移 |
20.在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述错误的是( )
| A. | 负极附近SO42- 逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 反应一段时间后,溶液的H+浓度降低 | |
| D. | 铜片上有H2逸出 |
17.下列实验中没有颜色变化的是( )
| A. | 葡萄糖溶液与新制的Cu(OH)2悬浊液混合加热 | |
| B. | 木板上涂抹浓硫酸 | |
| C. | 淀粉溶液中加入碘酒 | |
| D. | 苯加入到酸性高锰酸钾溶液中 |
14.对下列图象的描述中,正确的是( )
| A. |  根据图可判断正反应的△H<0 | |
| B. |  根据图,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5 | |
| C. | 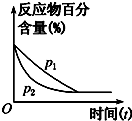 图可表示压强(p)对反应2A(g)+2B(g)?3C(g)+D(s)的影响 | |
| D. | 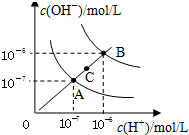 图为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
1.下列说正确的是( )
| A. | 羟基与氢氧根有相同的化学式和电子式 | |
| B. | 乙醇的官能团是-OH,乙醇是含-OH的化合物 | |
| C. | 常温下,1mol乙醇可与足量的Na反应生成11.2LH2 | |
| D. | 由工业酒精获得无水乙醇的方法是直接加热蒸馏 |
18.下列化合物分子中,在核磁共振氢谱图中能给出三种信号的是( )
| A. | 丙烷 | B. | 丙酮 | C. | 乙醛 | D. | 甲酸乙酯 |
19.下列哪种物质不属于以石油、煤和天然气为主要原料生产的三大合成材料是( )
| A. | 合成橡胶 | B. | 塑料 | C. | 合成纤维 | D. | 陶瓷 |