题目内容
【题目】下列溶液中微粒的物质的量浓度关系正确的是( )
A.0.1mol/L的NaHC2O4溶液中存在:c(Na+) + c(H+)=c(HC2O4) + c(C2O42-) +c(OH)
B.0.1 mol/L的NaHX溶液pH为4,该溶液中:c(HX)>c(H2X)>c(X2)>c(H+)>c(OH)
C.25℃时,pH=8的CH3COONa溶液中,c(CH3COOH)约为106 mol/L
D.在0.1mol/L的 NaF溶液中:c(HF)>c(F)
【答案】C
【解析】
A. NaHC2O4溶液中遵循电荷守恒,即c(Na+) + c(H+)=c(HC2O4) + 2c(C2O42-) +c(OH),A项错误;
B. 0.1 mol/L的NaHX溶液pH为4,说明HX-的电离程度大于水解程度,因HX-的电离方程式为:HX-![]() H++X2-,水解方程式为:HX-+H2O
H++X2-,水解方程式为:HX-+H2O![]() H2X+OH-,故c(X2)>c(H2X),该溶液中:c(HX)>c(X2)>c(H2X)>c(H+)>c(OH),B项错误;
H2X+OH-,故c(X2)>c(H2X),该溶液中:c(HX)>c(X2)>c(H2X)>c(H+)>c(OH),B项错误;
C. CH3COONa溶液中遵循质子守恒定律,即c(OH)=c(H+)+c(CH3COOH),因溶液的pH=8,故c(H+)=10-8mol/L,c(OH)=![]() =10-6mol/L,故c(CH3COOH)=10-6mol/L-10-8mol/L
=10-6mol/L,故c(CH3COOH)=10-6mol/L-10-8mol/L![]() 106 mol/L,C项正确;
106 mol/L,C项正确;
D. 在0.1mol/L的NaF溶液中,氟离子会发生水解,其水解方程式为:F-+H2O![]() HF+OH-,因水解比较微弱,故c(F)>c(HF),D项错误;
HF+OH-,因水解比较微弱,故c(F)>c(HF),D项错误;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】下列是25 ℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | Ksp=1.8×10-10 | Ksp=9.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A. H2CO3、HCO3-、CH3COO-、ClO- 在溶液中可以大量共存
B. 等体积等浓度的CH3COONa和NaClO中离子总数:CH3COONa <NaClO
C. 向浓度均为1.0×10-3 mol·L-1的KCl和K2CrO4混合溶液中滴加1.0×10-3 mol·L-1的AgNO3溶液,CrO42―先形成沉淀
D. 向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5∶9,此时溶液的pH=5
【题目】Ⅰ.实验室选用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素:
实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
(1)配平反应原理离子方程式:
___MnO4-+ __H2C2O4+___→___Mn2++ ___CO2↑+____H2O
(2)探究影响化学反应速率的因素
实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
a.探究温度对化学反应速率影响的实验编号是_______(填编号,下同),探究反应物浓度对化学反应速率影响的实验编号是_______。
b.混合液褪色时间由大到小的顺序是_____________。
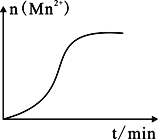
c.测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图所示,请解释“n(Mn2+)在反应起始时变化不大,一段时间后快速增大”的主要原因:_______。
Ⅱ. 用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(已知杂质不与KMnO4和H2SO4溶液反应)。
实验步骤:准确取1 g Na2C2O4样品,配成
(3)高锰酸钾溶液应装在____滴定管中。(填“酸式”或“碱式”)
(4)滴定至终点时的实验现象是:_________。
(5)计算样品中Na2C2O4的纯度是______%。