题目内容
11.除去镁粉中的少量铝粉,可以选用的试剂是( )| A. | 硫酸溶液 | B. | 氨水溶液 | C. | 盐酸溶液 | D. | 氢氧化钠溶液 |
分析 根据镁和铝性质的差异性分析,铝能和强碱反应,但镁和强碱不反应,据此分析解答.
解答 解:A.镁和铝都能与硫酸溶液反应生成盐和氢气,所以不能用硫酸溶液除去镁粉中的铝粉,故A错误;
B.氨水和镁、铝都不反应,所以不能用氨水除去镁粉中的铝粉,故B错误;
C.镁和铝都能与盐酸反应生成盐和氢气,所以不能用稀盐酸除去镁粉中的铝粉,故C错误;
D.氢氧化钠溶液能和铝反应生成可溶性的偏铝酸钠,镁和氢氧化钠溶液不反应,所以能用氢氧化钠溶液除去镁粉中的铝粉,故D正确.
故选D.
点评 本题考查了镁铝的性质,明确镁铝性质的差异性来分析解答,难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
6.关于硅及其化合物的叙述中,不正确的是( )
| A. | 硅的单质都可用作半导体材料 | B. | 石英可用来制造光导纤维 | ||
| C. | 碳化硅可用作砂纸、砂轮的磨料 | D. | 水玻璃可作黏合剂及耐火材料 |
16.根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
| A. | 第15列元素的最高价氧化物的化学式为R2O5 | |
| B. | 第2列元素中肯定没有非金属元素 | |
| C. | L层电子数为奇数的所有元素所在族的序数与元素原子L层电子数相等 | |
| D. | M层电子数为奇数的所有元素所在族的序数与元素原子M层电子数相等 |
20.V2O5 是一种新型光电材料.某课题组模拟生产V2O5工艺部分流程如下:
Ⅰ.配制偏钒酸钠(NaVO3)溶液
(1)向V2O5 固体中缓慢滴加NaOH溶液,边加热边搅拌至V2O5 固体完全溶解,反应的离子方程式为V2O5+2OH-=2VO3-+H2O.
Ⅱ.沉钒
一定条件下向偏钒酸钠溶液中加入氯化铵溶液,加热、搅拌得到偏钒酸铵沉淀.如图为部分因素对沉钒率的影响.
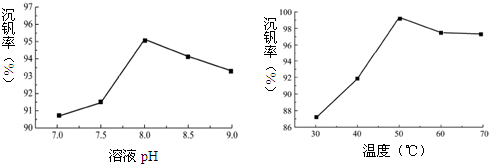
(2)为了提高沉钒率,应调节溶液pH=8.0.已知偏钒酸铵微溶于冷水,可溶于热水,结合图中信息,生成偏钒酸铵沉淀的反应是吸热(填“吸热”或“放热”)反应.
(3)该课题组对影响沉钒率的其他因素(除温度和pH)提出如下假设.
假设一:氯化铵溶液的浓度
假设二:偏钒酸钠溶液浓度
…
(4)结合上述最佳条件设计实验验证假设一,写出实验步骤与结论.
限选试剂:0.5mol/L的偏钒酸钠溶液、1mol/L的氯化铵溶液、蒸馏水,常见实验仪器任选.(提示:沉钒率可用专用仪器测定并计算)
Ⅲ.热分解
(5)偏钒酸铵灼烧产生五氧化二钒,该反应的化学方程式为2NH4VO3$\frac{\underline{\;△\;}}{\;}$2NH3↑+H2O↑+V2O5.
Ⅰ.配制偏钒酸钠(NaVO3)溶液
(1)向V2O5 固体中缓慢滴加NaOH溶液,边加热边搅拌至V2O5 固体完全溶解,反应的离子方程式为V2O5+2OH-=2VO3-+H2O.
Ⅱ.沉钒
一定条件下向偏钒酸钠溶液中加入氯化铵溶液,加热、搅拌得到偏钒酸铵沉淀.如图为部分因素对沉钒率的影响.

(2)为了提高沉钒率,应调节溶液pH=8.0.已知偏钒酸铵微溶于冷水,可溶于热水,结合图中信息,生成偏钒酸铵沉淀的反应是吸热(填“吸热”或“放热”)反应.
(3)该课题组对影响沉钒率的其他因素(除温度和pH)提出如下假设.
假设一:氯化铵溶液的浓度
假设二:偏钒酸钠溶液浓度
…
(4)结合上述最佳条件设计实验验证假设一,写出实验步骤与结论.
限选试剂:0.5mol/L的偏钒酸钠溶液、1mol/L的氯化铵溶液、蒸馏水,常见实验仪器任选.(提示:沉钒率可用专用仪器测定并计算)
| 实验步骤与结论: |
(5)偏钒酸铵灼烧产生五氧化二钒,该反应的化学方程式为2NH4VO3$\frac{\underline{\;△\;}}{\;}$2NH3↑+H2O↑+V2O5.
15.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )


| A. | 上下移动①中铜丝可控制生成SO2的量 | |
| B. | ②中选用品红溶液验证SO2的生成 | |
| C. | ③中选用NaOH溶液吸收多余的SO2 | |
| D. | 该反应中浓硫酸表现了强氧化性和脱水性 |
 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s) 盐桥(盛有KNO3琼脂的U型管)构成一个原电池设计的原电池如图所示,盐桥(盛有KNO3琼脂的U型管).请回 答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s) 盐桥(盛有KNO3琼脂的U型管)构成一个原电池设计的原电池如图所示,盐桥(盛有KNO3琼脂的U型管).请回 答下列问题: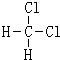 和
和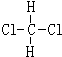 ⑤40K和40Ca ⑥
⑤40K和40Ca ⑥ 与
与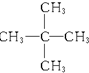 ⑦甲烷与C3H8.
⑦甲烷与C3H8.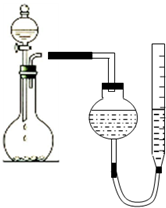 某学生用图所示的装置测定镁的相对原子质量:
某学生用图所示的装置测定镁的相对原子质量: