题目内容
10.有无色气体,可能含有乙烯和二氧化硫的混合气体通入装有溴水的试管中,溴水褪色.(1)甲同学认为溴水褪色的现象不能证明混合气体中有乙烯且乙烯具有不饱和性,其理由正确的是c.
a.乙烯与溴水易发生取代反应
b.若先除去二氧化硫,再将气体(纯净物)通入装有溴水的试管中,使溴水褪色的反应,也未必是加成反应?
c.使溴水褪色的物质,未必是乙烯?
(2)乙同学经过细致观察试管中另一实验现象后,证明有乙烯,请简述这一实验现象观察到液体分层,下层为油状液体.
分析 (1)乙烯是不饱和烃,能和溴水发生加成反应,SO2有强还原性,能和溴水发生氧化还原反应;
(2)如果有乙烯,则和溴水发生加成反应生成油状的1,2-二溴乙烷.
解答 解:(1)a、乙烯是不饱和烃,能和溴水发生加成反应而不是取代,故a错误;
b、若先除去二氧化硫,再将气体(纯净物)通入装有溴水的试管中,则使溴水褪色的反应必为乙烯和溴水的加成,故b错误;
c、SO2有强还原性,能和溴水发生氧化还原反应,故使溴水褪色的物质,未必是乙烯,故c正确.
故选c.
(2)如果有乙烯,则和溴水发生加成反应生成油状的1,2-二溴乙烷,密度比水大,在水的下层,故答案为:观察到液体分层,下层为油状液体.
点评 本题考查了乙烯的检验,应注意的是SO2有强还原性,能和溴水发生氧化还原反应而使溴水褪色.

练习册系列答案
相关题目
6.关于硅及其化合物的叙述中,不正确的是( )
| A. | 硅的单质都可用作半导体材料 | B. | 石英可用来制造光导纤维 | ||
| C. | 碳化硅可用作砂纸、砂轮的磨料 | D. | 水玻璃可作黏合剂及耐火材料 |
7.一定条件下,发生可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)下列叙述中,不能做为此可逆反应已经达到化学平衡状态的标志是( )
| A. | NH3的消耗速率等于NO的生成速率 | |
| B. | NH3的消耗速率等于NO的消耗速率 | |
| C. | NH3的浓度和NO的浓度都不发生改变 | |
| D. | 密闭容器内的压强不发生改变 |
4.下列有关物质用途的说法正确的是( )
| A. | 明矾可用作净水剂 | B. | 甲醛可用作食品防腐剂 | ||
| C. | 晶体硅可用于制造光导纤维 | D. | 铝制容器可长期存放酸性食物 |
5.工业上以锂辉石(Li2O•A12O3•4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂.其部分工艺流程如下:
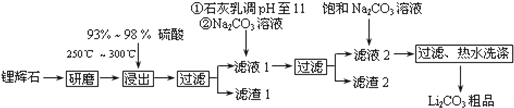
已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250℃~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②某些物质的溶解度(S)如下表所示.ⅠⅡⅢ
(1)从滤渣1中分离出Al2O3的部分流程图所示,括号表示加入的试剂,方框表示所得到的物质.则步骤Ⅱ中最佳反应的离子方程式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
滤渣1$→_{Ⅰ}^{()}$□$→_{Ⅱ}^{()}$□$→_{Ⅲ}^{灼烧}$Al2O3
(2)已知滤液1中的主要离子为Li+、Mg2+、Ca2+、SO42-,滤渣2的主要成分有Mg(OH)2和CaCO3.向滤液1中加入石灰乳的作用是(运用化学平衡原理简述,并写离子方程式)增加Ca2+、OH-的浓度,有利于Mg(OH)2、CaCO3的析出;Mg2++Ca(OH)2=Mg(OH)2+Ca2+.
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是2C1--2e-=Cl2↑.
②b中,生成Li2CO3反应的化学方程式是2LiOH+NH4HCO3=Li2CO3+NH3•H2O+H2O.

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250℃~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②某些物质的溶解度(S)如下表所示.ⅠⅡⅢ
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
滤渣1$→_{Ⅰ}^{()}$□$→_{Ⅱ}^{()}$□$→_{Ⅲ}^{灼烧}$Al2O3
(2)已知滤液1中的主要离子为Li+、Mg2+、Ca2+、SO42-,滤渣2的主要成分有Mg(OH)2和CaCO3.向滤液1中加入石灰乳的作用是(运用化学平衡原理简述,并写离子方程式)增加Ca2+、OH-的浓度,有利于Mg(OH)2、CaCO3的析出;Mg2++Ca(OH)2=Mg(OH)2+Ca2+.
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是2C1--2e-=Cl2↑.
②b中,生成Li2CO3反应的化学方程式是2LiOH+NH4HCO3=Li2CO3+NH3•H2O+H2O.
15.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )


| A. | 上下移动①中铜丝可控制生成SO2的量 | |
| B. | ②中选用品红溶液验证SO2的生成 | |
| C. | ③中选用NaOH溶液吸收多余的SO2 | |
| D. | 该反应中浓硫酸表现了强氧化性和脱水性 |
2.下列物质熔沸点高低的比较,正确的是( )
| A. | HF>HI | B. | CCl4<CF4 | C. | SiO2<CO2 | D. | NaCl<KCl |
19.下列说法正确的是( )
| A. | 分子晶体中一定存在分子间作用力 | |
| B. | 分子中含有两个氢原子的酸一定是二元酸 | |
| C. | 含有金属阳离子的晶体一定是离子晶体 | |
| D. | 元素的金属性越强,失去的电子数就越多 |
20.下列说法正确的是( )
| A. | 淀粉、纤维素、油脂均属于高分子化合物 | |
| B. | 煤经过气化和液化等物理变化可转化为清洁燃料 | |
| C. | 蛋白质水解的最终产物是多肽 | |
| D. | 石油的催化裂化主要是为了提高从石油得到的汽油等轻质油的产量 |