题目内容
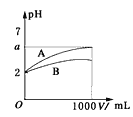
【题目】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液A、B的pH与溶液体积(V)的关系如下图所示:
(1)稀释前起始浓度大小关系:c(A)_____c(B)(填“>”、“<”、“=”)
(2)稀释前向两溶液中分别投入足量锌,开始放H2的速率A_______B,最终得H2体积 A______B。(填“<”“>”“=”)
(3)若使稀释后所得两溶液的pH重新相等,加水量_____________多。
【答案】< = < B
【解析】
(1)一元强酸完全电离,c(酸)=c(H+);弱酸部分电离产生电离平衡,c(酸)>c(H+)。1mL的强酸加水稀释到1000mL,则pH会在原来基础上增加3个单位,酸性强,pH变化幅度大,酸性弱,pH变化幅度小。以此解答;
(2)根据H+判断反应速率大小;根据最终电离产生H+的物质的量确定放出氢气的体积大小;
(3)根据图示,稀释相同倍数时溶液的pH:A>B,若使pH相同,B还需要加水稀释。
(1)1mL的强酸加水稀释到1000mL,则pH会在原来基础上增加3个单位,酸性越强,溶液的pH变化幅度大,酸性弱,pH变化幅度小。因A、B酸的强弱不同,一元强酸来说c(酸)=c(H+),对于一元弱酸,c(酸)>c(H+),根据图示可知:酸A稀释时pH变化较大,说明酸性A>B,所以A、B两种酸溶液的物质的量浓度A<B;
(2)稀释前,两溶液中c(H+)相等,分别向两种酸溶液中投入足量锌,开始放H2的速率A=B,由于酸性A>B,两种溶液的体积相等,则溶液中n(A)<n(B),反应产生H+的物质的量A<B,反应放出氢气的体积取决于溶液中最终电离产生氢离子的物质的量多少,所以最终得H2体积 A<B;
(3)根据图示可知,两种酸溶液稀释相同倍数时溶液的pH:A>B,若使溶液的pH稀释后仍然相同,B还需要加水稀释,即B稀释的倍数大,B加水量多。