题目内容
【题目】50mL0.50mol·L﹣1盐酸与50mL0.55molL﹣1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中的热量可计算中和热。回答下列问题:

(1)实验中改用60mL0.50mol·L﹣1盐酸跟50mL0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等”或“不相等”),所求中和热___(填“相等”或“不相等”),简述理由:___。
(2)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会___;用50mL0.50mol·L﹣1CH3COOH溶液(已知CH3COOH电离时吸热)进行上述实验,测得的中和热的数值会___。(均填“偏大”、“偏小”或“无影响”)
(3)平行地做一次这样的实验需要测定___次温度。
【答案】不相等 相等 中和热均是指强酸和强碱稀溶液反应生成1mol水时放出的热,与酸碱的用量无关 偏小 偏小 3
【解析】
(1)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(2)根据弱电解质电离吸热分析;
(3)需测3次温度,即测量盐酸的温度、测量氢氧化钠溶液的温度、测量混合液的最高温度。
(1)反应放出的热量和所用酸以及碱的量的多少有关,并改用60mL0.50mol·L﹣1盐酸跟50mL0.55molL﹣1 NaOH进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热均是指稀的强酸和稀的强碱反应生成1mol水时放出的热量,与酸碱的用量无关,所以用60mL0.50mol·L﹣1盐酸代替50mL0.50mol·L﹣1盐酸溶液进行上述实验,测得中和热数值相等;
故答案为:不相等;相等;中和热均是指强酸和强碱的稀溶液反应生成1mol水时放出的热,与酸碱的用量无关;
(2)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于中和热数值;CH3COOH溶液为弱酸,电离过程为吸热过程,所以用醋酸代替稀盐酸溶液反应,反应放出的热量小于中和热数值;
故答案为:偏小;偏小;
(3)实验要测盐酸的温度、测量氢氧化钠溶液的温度、测量混合液的最高温度,至少需要测量3次;
故答案为:3。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】双氧水(过氧化氢)常用于消毒、杀菌、漂白等。某化学兴趣小组同学,围绕着过氧化氢开展了调査研究与实验。
I.调查
(1)过氧化氢常用于消毒、杀菌、漂白等方面的主要原因是________。
(2)制备过氧化氢目前最常用的是乙基蒽醌法,其主要过程可以用如图表示,此过程中总反应式为________。

Ⅱ.不稳定性实验研究
(3)为了探究温度、催化剂等外界条件对 H2O2的分解速率的影响,某兴趣小组同学设计了如下三组实验,部分实验数据已经填在下面表中。
实验编号 | T/X | H2O2初始浓度/mol·L-1 | FeCl3初始浓度/mol·L-1 |
I | 20 | 1.0 | _______ |
II | 50 | 1.0 | 0 |
III | 50 | ___________ | 0.1 |
实验I、Ⅱ研究______对分解速率的影响,实验Ⅱ、Ⅲ研究催化剂对分解速率的影响,则实验Ⅲ中H2O2初始浓度应为________mol·L-1。
III.过氧化氢含量的实验测定
兴趣小组同学用0.1000mol·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+=2Mn2+ +8H2O+5O2↑
(4)用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为________mol·L-1(保留三位有效数字)。
【题目】某温度时,两个恒容密闭容器中仅发生反应2NO2(g)![]() 2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器 编号 | 起始浓度(mol·L1) | 平衡浓度(mol·L1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.6 | 0.1 | 0 | |
下列说法不正确的是
A.Ⅰ中NO2的平衡转化率约为66.7%
B.Ⅱ中达到平衡状态时,c(O2)<0.2 mol·L1
C.该反应的化学平衡常数可表示为K=![]()
D.升高温度,该反应的化学平衡常数减小
【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g) ![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(S)+2NO(g)+Cl2(g) K2
2NaNO3(S)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g) ![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=________________;
(2)已知几种化学键的键能数据如下表(NO分子中氮氧键键能为630 kJ/mol,亚硝酸氯的结构为Cl-N=O):
化学键 | N | Cl-Cl | Cl-N | N=O |
键能/kJmol-1 | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g) ![]() 2ClNO(g)反应的△H3和a的关系为△H3=________;
2ClNO(g)反应的△H3和a的关系为△H3=________;
(3)在1L的恒容密闭容器中充入2molNO(g)和1molCl(g),在不同温度下测得c(ClNO)与时间的关系如图A:
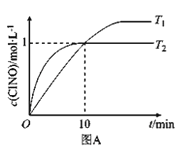
①由图A可判断T1________T2,该反应的△H________0(填“>”“<”或“=”);
②反应开始到10min时NO的平均反应速率v(NO)=________;
③T2时该反应的平衡常数K=____________;
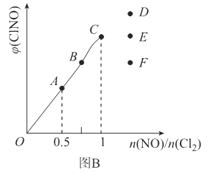
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化如图B,则A、B、C三状态中,NO的转化率最大的是________点。
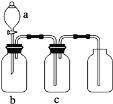
【题目】如图装置可用于制取、提纯并收集表格中的四种气体![]() 、b、c表示相应仪器中加入的试剂
、b、c表示相应仪器中加入的试剂![]() ,其中可行的是( )
,其中可行的是( )
选项 | 气体 | a | b | c |
|
A |
| 浓硝酸 | 铜片 | NaOH溶液 | |
B |
| 浓硫酸 | Cu | 酸性 | |
C |
| 浓氨水 | 生石灰 | 碱石灰 | |
D |
| 稀硝酸 |
| 浓硫酸 |
A.A