题目内容
【题目】在一密闭容器中进行如下反应2SO2(g)+O2(g)![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,当反应至正、逆反应速率相等时,可能存在的数据是( )
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,当反应至正、逆反应速率相等时,可能存在的数据是( )
A.SO2为0.4mol·L-1、O2为0.2mol·L-1B.SO2为0.25mol·L-1
C.SO2、SO3均为0.15mol·L-1D.SO3为0.4mol·L-1
【答案】B
【解析】
利用原子守恒和可逆反应的特点进行分析;
A.该反应为可逆反应,不能完全进行到底,即c(SO2)<0.4mol·L-1,c(O2)<0.2mol·L-1,故A错误;
B. 当SO3完全反应,则SO2的浓度应为0.4mol·L-1,SO2的浓度增大,反应向逆反应方向进行,则c(SO2)应在0.2mol·L-1~0.4mol·L-1之间,即c(SO2)可能为0.25mol·L-1,故B正确;
C. 根据硫原子守恒,SO2和SO3浓度之和是0.4mol·L-1,故C错误;
D. 该反应为可逆反应,不能完全进行到底,即c(SO3)<0.4mol·L-1,故D错误;
答案:B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g) ![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(S)+2NO(g)+Cl2(g) K2
2NaNO3(S)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g) ![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=________________;
(2)已知几种化学键的键能数据如下表(NO分子中氮氧键键能为630 kJ/mol,亚硝酸氯的结构为Cl-N=O):
化学键 | N | Cl-Cl | Cl-N | N=O |
键能/kJmol-1 | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g) ![]() 2ClNO(g)反应的△H3和a的关系为△H3=________;
2ClNO(g)反应的△H3和a的关系为△H3=________;
(3)在1L的恒容密闭容器中充入2molNO(g)和1molCl(g),在不同温度下测得c(ClNO)与时间的关系如图A:
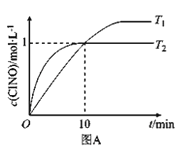
①由图A可判断T1________T2,该反应的△H________0(填“>”“<”或“=”);
②反应开始到10min时NO的平均反应速率v(NO)=________;
③T2时该反应的平衡常数K=____________;
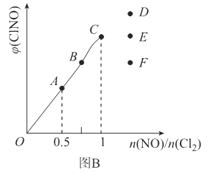
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化如图B,则A、B、C三状态中,NO的转化率最大的是________点。
【题目】如图装置可用于制取、提纯并收集表格中的四种气体![]() 、b、c表示相应仪器中加入的试剂
、b、c表示相应仪器中加入的试剂![]() ,其中可行的是( )
,其中可行的是( )
选项 | 气体 | a | b | c |
|
A |
| 浓硝酸 | 铜片 | NaOH溶液 | |
B |
| 浓硫酸 | Cu | 酸性 | |
C |
| 浓氨水 | 生石灰 | 碱石灰 | |
D |
| 稀硝酸 |
| 浓硫酸 |
A.A