题目内容
11. 氮元素可形成卤化物、氮化物、叠氮化物及配合物等许多化合物.
氮元素可形成卤化物、氮化物、叠氮化物及配合物等许多化合物.(1)NF3的沸点为-129℃,其分子的空间构型为三角锥形.
(2)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.
①与N3-互为等电子体的分子、离子有N2O或CO2或CS2或BeCl2、SCN-(各举1例).
②叠氮化物、氰化物都能与Fe2+、Cu2+及Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4.钴的基态原子核外电子排布式为[Ar]3d74s2;NH3中N原子的杂化类型是sp3;
③NaN3与KN3的结构类似,则NaN3的晶格能>KN3的晶格能.(填“>”或“<”)
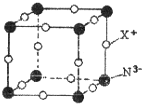
(3)元素X与N形成的氮化物中,X+与N3-形成晶体的结构如图所示.每个N3-与其距离最近的X+有6个.
分析 (1)NF3中N原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断空间构型;
(2)①原子个数相等、价电子数相等的微粒互为等电子体;
②Co是27号元素,其原子核外有27个电子,根据构造原理书写其基态原子核外电子排布式;
氨气分子中N原子价层电子对个数是4,根据价层电子对互斥理论判断N原子杂化类型;
③离子晶体晶格能与离子半径成反比,与电荷成正比;
(3)该晶胞中每个N3-与其距离最近的X+个数为6.
解答 解:(1)NF3中N原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论知,该分子空间构型是三角锥形,故答案为:三角锥形;
(2)①原子个数相等、价电子数相等的微粒互为等电子体,则与N3-互为等电子体的分子、离子有N2O或CO2或CS2或BeCl2、SCN-,
故答案为:N2O或CO2或CS2或BeCl2;SCN-;
②Co是27号元素,其原子核外有27个电子,根据构造原理书写其基态原子核外电子排布式为[Ar]3d74s2;
氨气分子中N原子价层电子对个数是4,根据价层电子对互斥理论判断N原子杂化类型为sp3,
故答案为:[Ar]3d74s2;sp3;
③离子晶体晶格能与离子半径成反比,与电荷成正比,钠离子和钾离子所带电荷相等,钠离子半径小于钾离子,所以NaN3的晶格能>KN3的晶格能,故答案为:>;
(3)该晶胞中每个N3-上下、左右、前后各有一个X+,所以每个N3-与其距离最近的X+有6个,故答案为:6.
点评 本题考查物质结构和性质,涉及配位数计算、原子核外电子排布、等电子体、微粒空间构型判断、原子杂化方式判断等知识点,为高频考点,侧重考查学生计算及空间想象能力,利用价层电子对互斥理论、构造原理等即可解答,题目难度不大.

练习册系列答案
相关题目
1.下列有关实验及操作的叙述中,错误的是( )
| A. | 用水将苯、乙酸、四氯化碳区分开来 | |
| B. | 在实验室中通常将钠保存在汽油里 | |
| C. | 用稀硝酸洗去残留在试管壁上的银 | |
| D. | 如果苯酚溶液沾到皮肤上,应立即用酒精洗涤 |
2.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深 | |
| C. | 反应CO+NO2?CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动 | |
| D. | 打开啤酒瓶盖后产生大量的气泡 |
19.依据题目要求回答下列问题.
(1)常温下,浓度均为 0.l mol•L-1的下列六种溶液的pH如下表:
①上述盐溶液中的阴离子,结合H+ 能力最强的是CO32-.
②浓度均为0.0l mol•L-1的下列五种物质的溶液中,酸性最强的是D(填编号);将各溶液分别稀释100倍,pH变化最小的是C(填编号)
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是D(填编号)
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+NaClO═NaHCO3+HClO
D.CO2+H2O+2C6H5ONa═Na2CO3+2C6H5OH
④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-+H2O=CO2↑+Cl-+HClO.
(2)已知常温下Cu(OH)2的Ksp=2×10-20.又知常温下某CuSO4溶液里 c(Cu2+)=0.02mol•L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于5.
(1)常温下,浓度均为 0.l mol•L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②浓度均为0.0l mol•L-1的下列五种物质的溶液中,酸性最强的是D(填编号);将各溶液分别稀释100倍,pH变化最小的是C(填编号)
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是D(填编号)
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+NaClO═NaHCO3+HClO
D.CO2+H2O+2C6H5ONa═Na2CO3+2C6H5OH
④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-+H2O=CO2↑+Cl-+HClO.
(2)已知常温下Cu(OH)2的Ksp=2×10-20.又知常温下某CuSO4溶液里 c(Cu2+)=0.02mol•L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于5.
6.铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+$?_{充电}^{放电}$2Pb2++2H2O.下列有关新型液流式铅酸蓄电池的说法正确的是( )
| A. | 充放电时,溶液中Pb2+浓度保持不变 | |
| B. | 放电时转移2mol电子,消耗2molPb | |
| C. | 放电时的负极反应式为:Pb-2e-═Pb2+ | |
| D. | 充电时的阳极反应式为:Pb2++4OH+2e-═PbO2+2HO |
16.下列反应的离子方程式不正确的是( )
| A. | 氨气通入稀硫酸中:NH3+H+═NH4+ | |
| B. | 小苏打溶液和烧碱溶液反应:HCO3-+2OH-═CO32-+H2O | |
| C. | 一小块金属钠投入水中:Na+2H2O═Na++OH-+H2↑ | |
| D. | 澄清石灰水中加入过量硝酸:H++OH-═H2O |
1.下列物质中可使酸性高锰酸钾溶液褪色,不能使溴水褪色的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 乙醇 | D. | 苯 |
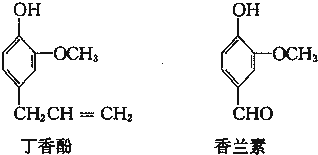
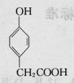 、
、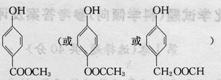 .
.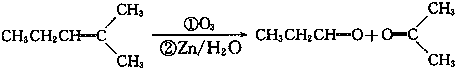
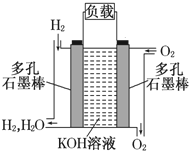 如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点.试回答下列问题:
如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点.试回答下列问题: