题目内容
1.下列物质中可使酸性高锰酸钾溶液褪色,不能使溴水褪色的是( )| A. | 甲烷 | B. | 乙烯 | C. | 乙醇 | D. | 苯 |
分析 具有还原性的物质、含有碳碳不饱和键或醛基或连接苯环的碳原子上含有H原子的苯的同系物或醇都能被酸性高锰酸钾溶液氧化,含有碳碳不饱和键或醛基的有机物能和溴发生反应而使溴水褪色,据此分析解答.
解答 解:A.甲烷性质较稳定,和酸性高锰酸钾、溴水都不反应,故A错误;
B.乙烯中含有碳碳双键,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,能和溴发生加成反应而使溴水褪色,故B错误;
C.乙醇可被酸性高锰酸钾溶液氧化而使之褪色,但不与溴水反应,不能使之褪色,故C正确;
D.苯性质较稳定,和酸性高锰酸钾溶液、溴水都不反应,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,注意乙醇能被酸性高锰酸钾或重铬酸钾氧化,为易错点.

练习册系列答案
相关题目
12.下列物质的主要成分不是甲烷的是( )
| A. | 沼气 | B. | 天然气 | C. | 裂解气 | D. | 可燃冰 |
16.下列物质所属类别不正确的是( )
| A. | 纯碱--碱 | B. | 氯化铝--盐 | ||
| C. | 金属钠--还原剂 | D. | 二氧化硅--酸性氧化物 |
6.2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,下列有关说法正确的是( )
| A. | 丙烷分子中三个碳原子在一条直线上 | |
| B. | 符合通式CnH2n+2的均属于烷烃 | |
| C. | 丙烷的二氯代物有5种 | |
| D. | 丁烷能与氯气在光照时发生加成反应 |
13.下列元素原子半径最小的是( )
| A. | Na | B. | Mg | C. | Al | D. | Si |
10.NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A. | 1mol乙烯与乙醇的混合物在氧气中充分燃烧,消耗氧气的分子数为一定为3NA | |
| B. | 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 0.1mol乙烷分子中含有的共价键数目为0.7NA | |
| D. | 在标准状态下,2.24L己烷含有的氢原子数目为1.4NA |
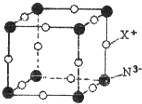 氮元素可形成卤化物、氮化物、叠氮化物及配合物等许多化合物.
氮元素可形成卤化物、氮化物、叠氮化物及配合物等许多化合物.