题目内容
【题目】某研究小组为探讨反应A(g)+2B(g) ![]() 2C(g)+D(s)在催化剂存在的条件下对最适宜反应条件进行了一系列的实验,并根据所得实验数据绘制出下图:图中C%为反应气体混合物中C的体积百分含量(所有实验的反应时间相同)。
2C(g)+D(s)在催化剂存在的条件下对最适宜反应条件进行了一系列的实验,并根据所得实验数据绘制出下图:图中C%为反应气体混合物中C的体积百分含量(所有实验的反应时间相同)。
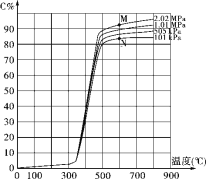
(1)该反应的反应热为ΔH_____0(填“>”、“<”或“=”)。
(2)点M和点N处平衡常数K的大小是:KM______KN(填“>”、“<”或“=”)。
(3)工业上进行该反应获得产品C的适宜条件是:度为______℃,选择该温度的理由是________________,压强为______,选择该压强的理由是__________________ 。
(4)试解释图中350℃前C%变化平缓而后急剧增大、500℃以后又缓慢增加的可能原因:_____________。
【答案】> = 500 低于500℃时,C%值太小,高于500℃时C%随温度的升高而增大的幅度不明显,但由于升温带来的燃料及设备成本要求会明显增加 101kPa 随着压强的增大,C%的增大幅度并不明显,而由于压强增大而带来的动力,设备成本的大幅度增加,故选择常压 该反应需要在特定的催化剂作用下才能顺利进行,而该催化剂只有在350℃以上才能体现催化活性并在500℃左右时催化效果最好,500℃以上的变化为温度变化导致平衡移动的情形
【解析】
试题(1)从图像看出,随着温度升高,C%增大,说明温度升高平衡向正反应方向移动,则反应是吸热反应,所以△H>0。(2)平衡常数只和温度有关,M、N两点所处的温度相同,故KM=KN。(3)获得产品C 的适宜条件是:温度为500℃,因为低于500℃时,C%值太小,高于500℃时C%随温度的升高而增大的幅度不明显,但由于升温带来的燃料及设备成本要求会明显增加。压强选择:101k Pa,是因为:随着压强的增大,C%的增大幅度并不明显,而由于压强增大而带来的动力,设备成本的大幅度增加,故选择常压。(4)350℃前C%变化平缓而后急剧增大、500℃以后又缓慢增加的可能原因是:该反应需要在特定的催化剂作用下才能顺利进行,而该催化剂只有在350℃以上才能体现催化活性并在500℃左右时催化效果最好,500℃以上的变化为温度变化导致平衡移动的情形。

【题目】温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. 反应0~4 min的平均速率υ(Z)=0.25 mol/(Lmin)
B. T1时,反应的平衡常数K1=1.2
C. 其他条件不变,9 min后,向容器中再充入1.6 molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大
D. 其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0
【题目】防治雾霾天气的主要措施有机动车临时交通管制、工矿企业停业限产、扬尘污染控制等。
(1)PM2.5是环保部门监测空气质量的重要指标。将某PM2.5样本用蒸馏水处理制成待测试样,测得试样中无机离子(OH-忽略不计)的种类和平均浓度如下表:
离子种类 | Na+ | NH4+ | SO42- | NO3- |
浓度(mol/L) | 2.0×10-6 | 2.8×10-5 | 3.5×10-5 | 6.0×10-5 |
则试样的pH为________________________。
(2)一定条件下,以CO和H2合成清洁能源CH3OH,其热化学方程式为CO(g)+2H2(g) CH3OH(g) ΔH,CO的平衡转化率与温度、压强的关系如图所示:

①该可逆反应的ΔH__________0(填“>”“<”或“=”)。A、B、C三点对应的平衡常数KA、KB、KC的大小关系是______________。压强:p1__________p2(填“>”“<”或“=”)。在T1条件下,由D点到B点过程中,正、逆反应速率之间的关系:v(正)___________v(逆)(填“>”“<”或“=”)。
②若在恒温恒容条件下进行上述反应,能表示该可逆反应达到平衡状态的是_________(填字母)。
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗CO的浓度等于生成CH3OH的浓度
③向恒压密闭容器中充入2 mol CO和4 mol H2,在p2、T2条件下达到平衡状态C点,此时容器容积为2 L,则在该条件下反应的平衡常数K为_________________________。