题目内容
【题目】防治雾霾天气的主要措施有机动车临时交通管制、工矿企业停业限产、扬尘污染控制等。
(1)PM2.5是环保部门监测空气质量的重要指标。将某PM2.5样本用蒸馏水处理制成待测试样,测得试样中无机离子(OH-忽略不计)的种类和平均浓度如下表:
离子种类 | Na+ | NH4+ | SO42- | NO3- |
浓度(mol/L) | 2.0×10-6 | 2.8×10-5 | 3.5×10-5 | 6.0×10-5 |
则试样的pH为________________________。
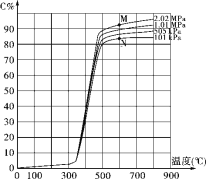
(2)一定条件下,以CO和H2合成清洁能源CH3OH,其热化学方程式为CO(g)+2H2(g) CH3OH(g) ΔH,CO的平衡转化率与温度、压强的关系如图所示:

①该可逆反应的ΔH__________0(填“>”“<”或“=”)。A、B、C三点对应的平衡常数KA、KB、KC的大小关系是______________。压强:p1__________p2(填“>”“<”或“=”)。在T1条件下,由D点到B点过程中,正、逆反应速率之间的关系:v(正)___________v(逆)(填“>”“<”或“=”)。
②若在恒温恒容条件下进行上述反应,能表示该可逆反应达到平衡状态的是_________(填字母)。
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗CO的浓度等于生成CH3OH的浓度
③向恒压密闭容器中充入2 mol CO和4 mol H2,在p2、T2条件下达到平衡状态C点,此时容器容积为2 L,则在该条件下反应的平衡常数K为_________________________。
【答案】4 < KA=KB>KC < > AC 1 (L/mol)2
【解析】
(1)根据电荷守恒计算c(H+);(2)①根据图像可知,升高温度,CO的平衡转化率减小,平衡逆向移动;K只与温度有关,正反应放热,升高温度平衡逆向移动,平衡常数减小;CO(g)+2H2(g) CH3OH(g),正反应气体物质的量减少,增大压强平衡正向移动,CO转化率增大;在T1条件下,由D点到B点过程中,CO转化率增大,反应正向进行;②当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些变量也不发生变化时,一定达到平衡状态。③在p2、T2条件下达到平衡状态C点,CO的平衡转化率为0.5,利用“三段式”计算平衡常数;
(1)根据电荷守恒,c(H+)= 2×3.5×10-5+6.0×10-5-2.0×10-6-2.8×10-5=1×10-4 mol/L,所以pH=4;(2)①根据图像可知,升高温度,CO的平衡转化率减小,平衡逆向移动,所以正反应放热,ΔH<0;K只与温度有关,A、B温度相同,所以KA=KB,正反应放热,升高温度平衡逆向移动,平衡常数减小,B![]() C温度升高,所以KB>KC,故KA=KB>KC;CO(g)+2H2(g) CH3OH(g),正反应气体物质的量减少,增大压强平衡正向移动,CO转化率增大,
C温度升高,所以KB>KC,故KA=KB>KC;CO(g)+2H2(g) CH3OH(g),正反应气体物质的量减少,增大压强平衡正向移动,CO转化率增大,![]() 温度下,B点转化率大于A,所以B压强大于A,p1<p2;在T1条件下,由D点到B点过程中,CO转化率增大,反应正向进行,所以v(正)>v(逆);②反应过程中CO的体积分数是变量,当CO的体积分数保持不变时,一定达到平衡状态,故选A;根据
温度下,B点转化率大于A,所以B压强大于A,p1<p2;在T1条件下,由D点到B点过程中,CO转化率增大,反应正向进行,所以v(正)>v(逆);②反应过程中CO的体积分数是变量,当CO的体积分数保持不变时,一定达到平衡状态,故选A;根据![]() ,反应过程中密度是恒量,容器内混合气体的密度保持不变,不一定平衡,故不选B;根据
,反应过程中密度是恒量,容器内混合气体的密度保持不变,不一定平衡,故不选B;根据![]() ,反应过程中,气体物质的量是变量,所以平均摩尔质量是变量,容器内混合气体的平均摩尔质量保持不变,一定平衡,故选C;单位时间内消耗CO的浓度等于生成CH3OH的浓度,都是正反应速率,不一定平衡,故不选D。③在p2、T2条件下达到平衡状态C点,CO的平衡转化率为0.5,
,反应过程中,气体物质的量是变量,所以平均摩尔质量是变量,容器内混合气体的平均摩尔质量保持不变,一定平衡,故选C;单位时间内消耗CO的浓度等于生成CH3OH的浓度,都是正反应速率,不一定平衡,故不选D。③在p2、T2条件下达到平衡状态C点,CO的平衡转化率为0.5,
CO(g)+2H2(g) CH3OH(g)
开始 2mol 4mol 0
转化 1mol 2mol 1mol
平衡 1mol 2mol 1mol
![]() 1 (L/mol)2。
1 (L/mol)2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
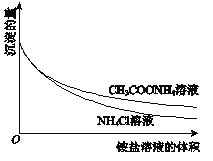
小学生10分钟应用题系列答案【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g) ![]() 2XY3(g) △H=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) △H=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量变化的数值 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q(Q>0)kJ |
下列叙述正确的是
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,两个容器中XY3的物质的量浓度均为2mol·L-1
C. 容器②中反应达到平衡时放出的热量为Q kJ
D. 若容器①体积为 0.20 L,则达平衡时放出的热量大于23.15 kJ
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应:2NO(g)+Cl2(g)2ClNO(g)获得。
(1)氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)2ClNO(g) K3
则K3=__________(用K1、K2表示)。
(2)已知几种化学键的键能数据如表所示(亚硝酰氯的结构为Cl-N=O):
化学键 | N≡O (NO) | Cl-Cl | Cl-N | N=O |
键能/(kJ/mol) | 630 | 243 | a | 607 |
则反应2NO(g)+Cl2(g)2ClNO(g)的ΔH和a的关系为ΔH= _______________kJ/mol。
(3)300℃时,2NO(g)+Cl2(g)2ClNO(g)的正反应速率表达式为v(正)=k·cn(ClNO),测得速率和浓度的关系如表所示:
序号 | c(ClNO)/(mol/L) | v/(x10-8mol·L-1·S-1) |
① | 0.30 | 0.36 |
② | 0.60 | 1.44 |
③ | 0.90 | 3.24 |
n=________________;k=__________________________。
(4)按投料比[n(NO):n(Cl2)=2:1]把 NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:

①在p压强条件下,M点时容器内NO的体积分数为______________。
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=________(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 x体积分数)。
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图B所示,则A、B、C三状态中,NO的转化率最大的是______________点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。