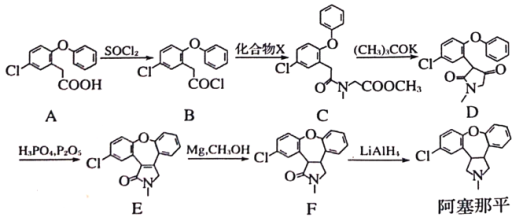
题目内容
【题目】热值是指一定条件下单位质量的物质完全燃烧所放出的热量。已知H2(g)、CO(g)和CH3OH(l)的热值分别为143 kJ· g-1、10 kJ·g-1和23 kJ·g-1。请回答下列问题:
(1)写出CO燃烧反应的热化学方程式为__________________________________________。
(2)表示甲醇燃烧热的热化学方程式为__________________________________________。
(3)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为__________________________。
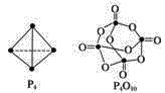
(4)白磷与氧可发生如下反应:P4(g)+5O2(g)![]() P4O10(g)。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ/mol、P—O b kJ/mol、P=O c kJ/mol、O=O d kJ/mol根据图示的分子结构和有关数据计算该反应的反应热_____________。
P4O10(g)。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ/mol、P—O b kJ/mol、P=O c kJ/mol、O=O d kJ/mol根据图示的分子结构和有关数据计算该反应的反应热_____________。
【答案】CO(g) +1/2O2(g)=CO2(g) ΔH=-280 kJ· mol-1或2CO(g)+O2(g)===2CO2(g) ΔH=-560 kJ·mol-1 CH3OH(l)+3/2 O2(g)=CO2(g)+2H2O(l) ΔH=-736 kJ· mol-1 CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=-456 kJ· mol-1 (6a+5d﹣4c﹣12b)kJ/mol
【解析】
(1)CO(g)的热值为10 kJ·g-1,即1gCO完全燃烧放出10 kJ的热量,则1molCO(28g)完全燃烧放出280 kJ的热量,CO燃烧反应的热化学方程式为CO(g) +![]() O2(g)=CO2(g) ΔH=-280 kJ· mol-1,故答案为:CO(g) +
O2(g)=CO2(g) ΔH=-280 kJ· mol-1,故答案为:CO(g) +![]() O2(g)=CO2(g) ΔH=-280 kJ· mol-1;
O2(g)=CO2(g) ΔH=-280 kJ· mol-1;
(2) CH3OH(l)的热值为23 kJ·g-1,则1mol甲醇(32g)完全燃烧放出736kJ的热量,甲醇燃烧热的热化学方程式为CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-736 kJ· mol-1,故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) ΔH=-736 kJ· mol-1,故答案为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-736 kJ· mol-1;
O2(g)=CO2(g)+2H2O(l) ΔH=-736 kJ· mol-1;
(3)CO(g)和CH3OH(l)的热值分别为10kJg-1和23kJg-1,即由CO(g)和CH3OH(l)的燃烧热△H分别为-280.0kJmol-1和-736kJmol-1,则①CO(g)+![]() O2(g)=CO2(g)△H=-280.0kJmol-1,②CH3OH(l)+
O2(g)=CO2(g)△H=-280.0kJmol-1,②CH3OH(l)+![]() O2(g)=CO2(g)+2 H2O(l)△H=-736kJmol-1,由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l) △H=-736kJmol-1-(-280.0kJmol-1)=-456kJmol-1,故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-456kJmol-1;
O2(g)=CO2(g)+2 H2O(l)△H=-736kJmol-1,由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l) △H=-736kJmol-1-(-280.0kJmol-1)=-456kJmol-1,故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-456kJmol-1;
(4)各化学键键能为P-PakJmol-1、P-ObkJmol-1、P=OckJmol-1、O=OdkJmol-1。
反应热△H=反应物总键能-生成物总键能,所以反应P4+5O2=P4O10 △H=6akJmol-1+5dkJmol-1-(4ckJmol-1+12bkJmol-1)=(6a+5d-4c-12b)kJmol-1,故答案为:(6a+5d-4c-12b)kJmol-1。