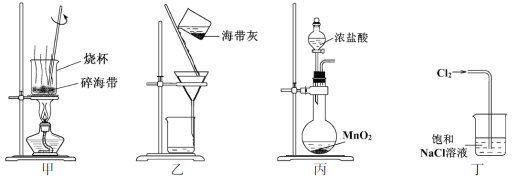
题目内容
【题目】温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. 反应0~4 min的平均速率υ(Z)=0.25 mol/(Lmin)
B. T1时,反应的平衡常数K1=1.2
C. 其他条件不变,9 min后,向容器中再充入1.6 molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大
D. 其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0
【答案】D
【解析】
A.由表中数据可求得前4min内消耗Y为0.10mol,v(Y)=![]() ,所以V(Z)=2V(Y)=0.05mol/(Lmin),A错误;
,所以V(Z)=2V(Y)=0.05mol/(Lmin),A错误;
B.由表中数据可知7min时反应到达平衡,反应的三段式为
X(g) + Y(g) ![]() 2Z(g)
2Z(g)
起始浓度(mol/L)0.16 0.16 0
变化量(mol/L) 0.06 0.06 0.12
平衡浓度(mol/L)0.1 0.1 0.12
所以平衡常数K=![]() ,B错误;
,B错误;
C.其他条件不变,9min时是平衡状态,再充入1.6molX,平衡向正反应方向移动,再次达到平衡时Y的转化率增大,由于X加入量大于平衡移动消耗量,所以再次达到平衡时,X的浓度增大,C错误;
D.T1时,平衡常数K=1.44,降温到T2达到平衡时,平衡常数K2=4,说明降低温度平衡正向移动,使K增大,所以该反应正向为放热反应, D正确;
故合理选项是D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验过程可以达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 配制0.4000 mol·L1的NaOH溶液 | 称取4.0 g固体NaOH于250 mL容量瓶中,加入蒸馏水溶解,定容至刻度线即可。 |
B | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
C | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
D | 制备Fe(OH)3胶体 | 通常是将Fe(OH)3固体溶于热水中即可 |
A. A B. B C. C D. D