题目内容
下列各表述与示意图一致的是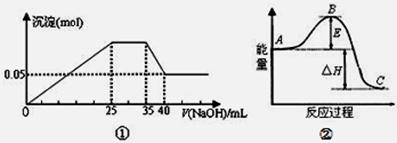
| A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:3:2 |
| B.图①中使用的NaOH的浓度为2mol/L |
| C.图②中曲线表示某反应过程的能量变化。若使用催化剂,B点会降低 |
| D.图②中物质A反应生成物质C,△H>0; |
C
解析试题分析:A、根据图中各段含义,得到NaOH溶液为25mL到35mL是与NH4+反应,35mL到40mL是与氢氧化铝反应,剩余的为氢氧化镁,故得到n(Mg2+)=0.05mol,根据Al3+与NaOH反应沉淀与溶解时量的关系为3:1确定,与Mg2+反应的NaOH溶液体积为25-5×3=10mL,c(NaOH)=0.05×2÷0.01=10mol/L
根据35mL到40mL段得n(Al3+)=n(NaOH)=0.005×10=0.05mol,
根据25mL到35mL段得n( NH4+)=n(NaOH)=0.01×10=0.1mol
n(Mg2+):n(Al3+):n( NH4+)=0.05mol:0.05mol:0.1mol=1:1:2
本问也可以直接根据25mL到35mL和35mL到40mL两段判断出Al3+、NH4+量的关系,确定答案,错误;B、错误;C、使用催化剂改变反应的活化能,但不能改变反应的焓变,正确;D、物质A反应生成物质C,为放热反应,△H<0,错误。
考点:考查图像有关问题。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案下列说法正确的是( )
| A.强电解质一定可溶于水 |
| B.弱电解质是指部分溶于水的化合物 |
| C.弱电解质的导电性一定弱 |
| D.强酸、强碱不一定抑制弱酸弱碱的电离 |
下列反应的离子方程式书写正确的是:( )
| A.氯化铝溶液中加入过量氨水:Al3+ + 4NH3?H2O= AlO2- + 4NH4+ + 2H2O |
| B.NaAlO2溶液中通入少量CO2:2A1O2_+CO2+3H2O=2Al(OH)3↓+CO32- |
| C.碳酸氢铵溶液和足量氢氧化钠溶液反应: NH4+ + OH - =NH3·H2O |
| D.NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3- + OH- +Ba2+ = H2O + BaCO3↓ |
下列离子方程式中,正确的是( )
| A.NH4HSO3溶于少量NaOH溶液中: HSO3-+OH- = SO32-+H2O |
| B.酸性KMnO4溶液与双氧水反应: 2MnO4-+ 7H2O2 + 6H+= 2Mn2+ + 6O2↑+ 10H2O |
| C.向氯化银悬浊液中滴入饱和碘化钾溶液:Ag++ I-= AgI ↓ |
| D.标准状况下672mL Cl2通入100mL0.1 mol·L-1FeBr2溶液中: |
将足量CO2通入下列各溶液中,所含离子还能大量共存的是
| A.K+、SiO32-、Cl-、NO3- |
| B.H+、NH4+、AlO2-、SO42- |
| C.Na+、S2-、CO32-、SO42- |
| D.Na+、Ba2+、CH3COO-、HCO3- |
在一种能使pH试纸变红色的溶液中,下列离子因发生氧化还原反应而不能大量共存的
是
①Ag+、Na+、Al3+、Cl- ②Fe2+、NO3-、Cl-、Na+
③K+、Mg2+、CH3COO-、SO42- ④K+、H+、SO32-、I-
⑤Na+、NO3-、SO42-、I-
| A.②⑤ | B.①②④ | C.②③⑤ | D.全部 |
某溶液可能含有Cl–、SO42–、CO32–、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤、洗涤、灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
| A.至少存在5种离子 |
| B.Cl– 一定存在,且c(Cl–)≥0.4mol/L |
| C.SO42–、NH4+一定存在,Cl–可能不存在 |
| D.CO32–、Al3+一定不存在,K+可能存在 |
常温下,下列各组离子在指定溶液中可能大量共存的是( )
| A.在碱性溶液中:K+、Cl-、Na+、 CO32- |
| B.在c(H+)/ c(OH-)=1×10-12的溶液中:Ca2+、Cl-、K+、NH4+ |
| C.澄清透明溶液中:Cu2+、Fe3+、I-、SO42- |
| D.与铝粉反应放出氢气的无色溶液中:K+、NO3-、Cl-、HCO3- |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| C.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br - |
| D.加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- |