题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| C.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br - |
| D.加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- |
C
解析试题分析:A.NO3-、H+、Fe2+会发生氧化还原反应而不能大量共存。错误。B.甲基橙呈红色的溶液是酸性溶液,H+和AlO2-发生离子反应,不能共存。错误。C.c(H+)=10-12 mol·L-1的溶液是碱性溶液,离子不会发生任何反应。正确。D.加入苯酚显紫色的溶液中含有Fe3+,Fe3+和I-发生离子反应:2Fe3++2I-=2Fe2++I2不能共存。
考点:考查离子共存问题的知识。

练习册系列答案
相关题目
下列各表述与示意图一致的是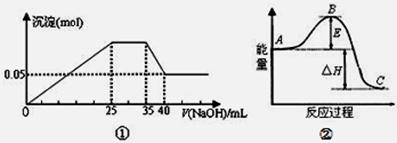
| A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:3:2 |
| B.图①中使用的NaOH的浓度为2mol/L |
| C.图②中曲线表示某反应过程的能量变化。若使用催化剂,B点会降低 |
| D.图②中物质A反应生成物质C,△H>0; |
下列离子方程式正确的是
| A.向Ca(OH)2溶液中通入过量CO2:Ca2++2OH—+CO2=CaCO3↓+H2O |
| B.将盐酸溶液滴加到石灰石中:CO32—+2H+=CO2↑+H2O |
| C.将少量H2SO4溶液滴加到Ba(OH)2溶液中:2H++SO42—+2OH—+Ba2+=BaSO4↓+2H2O |
| D.将铁粉加入到AgNO3溶液中:Fe+Ag+=Ag+Fe2+ |
下列各式中,属于正确的电离方程式的是
| A.HCO3- = CO32- + H+ | B.HCO3- +OH- = H2O + CO32- |
| C.NH3+ H+ = NH4+ | D.NH3·H2O 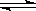 NH4+ + OH- NH4+ + OH- |
下列离子方程式书写正确的是( )
| A.氯化钡溶液中通入二氧化碳气体:Ba2++CO2+H2O=BaCO3↓+2H+ |
| B.次氯酸钙溶液中通人少量SO2气体:Ca2++2ClO一+SO2+H2O=CaSO3↓+2HClO |
| C.醋酸和碳酸氢钠溶液混合:CH3COOH+HCO3-=CO2↑+H2O+CH3COO- |
| D.碳酸氢镁溶液中加入过量石灰水: |
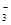 +Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓
+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ 下列文字表述与反应方程式对应且正确的是
| A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Ag++Br-=AgBr↓ |
| B.可用碳酸钠溶液洗涤油污:CO32-+H2O=HCO3-+OH- |
C.用惰性电极电解饱和KCl溶液:2H++2Cl- H2↑+Cl2↑ H2↑+Cl2↑ |
| D.FeSO4溶液与双氧水、稀硫酸混合:2Fe2++H2O2+2H+=2Fe3++2H2O |
下列解释事实的离子方程式正确的是( )
| A.向明矾溶液中加入氢氧化钡溶液至沉淀质量最大Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
| B.向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++HCO3-+OH- =CaCO3↓+H2O |
C.用惰性电极电解MgCl2溶液:2Cl-+2H2O 2OH- +Cl2↑+ H2↑ 2OH- +Cl2↑+ H2↑ |
| D.NaClO溶液中通入少量的SO2:ClO-+H2O+SO2=Cl-+SO42-+2H+ |
下列物质属于强电解质且能导电的是
①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥稀硫酸 ⑦乙酸
| A.⑤ | B.①②⑥ |
| C.②⑤⑥⑦ | D.①③④⑤⑥ |
下列离子方程式正确的是
| A.铝与稀盐酸反应 Al+2H+=Al3++H2↑ |
| B.三氯化铁溶液与氢氧化钠溶液反应 FeCl3+3OH-=Fe(OH)3↓+3Cl- |
| C.用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-=Cl-+ClO-+H2O |
| D.二氧化碳与石灰水反应 CO2+2OH-=CO32-+H2O |