题目内容
某溶液可能含有Cl–、SO42–、CO32–、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤、洗涤、灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
| A.至少存在5种离子 |
| B.Cl– 一定存在,且c(Cl–)≥0.4mol/L |
| C.SO42–、NH4+一定存在,Cl–可能不存在 |
| D.CO32–、Al3+一定不存在,K+可能存在 |
B
解析试题分析:加入过量NaOH溶液,加热,得到0.02mol气体说明含有0.02mol NH4+;同时产生红褐色沉淀说明一定有Fe3+,红褐色沉淀为Fe(OH)3,灼烧后得到的1.6g固体为Fe2O3,其物质的量为0.01mol,故溶液中含有0.02molFe3+;Fe3+与CO32–因发生双水解而不能共存,所以溶液中一定不存在CO32–;4.66g不溶于盐酸的沉淀为BaSO4,所以该溶液一定有SO42–,物质的量为0.02mol;不能确定是否存在Al3+和K+,根据电荷守恒可知,溶液中必定含有Cl–;若溶液中不含Al3+和K+,则n(Cl–)= 0.02mol×3+0.02mol–0.02mol×2=0.04mol,若溶液中含有Al3+和K+,则n(Cl–)>0.04mol,故c(Cl–)≥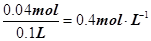 。正确答案选B。
。正确答案选B。
考点:考查离子推断及离子共存问题,考查学生的推理能力及计算能力。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案在pH=13的无色溶液中,下列各组离子能大量共存的是( )
| A.K+、Na+、HCO3-、NO3- | B.Na+、NH4+、NO3-、Cl- |
| C.K+、Na+、NO3-、Br- | D.K+、Cu2+、Cl-、SO42- |
将由NaOH、BaCl2、Al2(SO))3三种固体组成的混合物溶于足量的水中,充分溶解,向混合溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断不正确的是( )
| A.AB段发生反应的离子方程式为:Ba2++SO42-=BaSO4↓ |
| B.E点对应横坐标稀硫酸的体积为70 ml |
| C.D点表示的沉淀的化学式为Al(OH)3、BaSO4 |
| D.E点沉淀比A点沉淀质量大2.33g |
下列各表述与示意图一致的是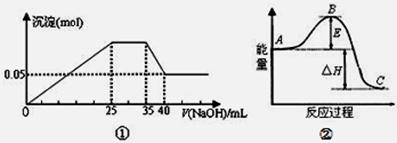
| A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:3:2 |
| B.图①中使用的NaOH的浓度为2mol/L |
| C.图②中曲线表示某反应过程的能量变化。若使用催化剂,B点会降低 |
| D.图②中物质A反应生成物质C,△H>0; |
下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是( )
| A.等体积、等物质的量浓度的明矾溶液和Ba(OH)2溶液混合:3Ba2++6OH -+2Al3++3SO42- ="==" 2Al(OH)3↓+3BaSO4↓ |
| B.FeSO4酸性溶液暴露在空气中:4Fe2+ + O2 + 2H2O = 4Fe3+ + 4OH - |
| C.向AlCl3 溶液中投入过量Na:2Al 3+ + 6Na + 6H2O = 2Al(OH)3 ↓ + 6Na+ + 3H2↑ |
| D.向FeBr2溶液中通入少量Cl2:2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2 Br2 + 6Cl- |
下列离子方程式书写正确的是:
| A.碳酸氢钙溶液中加入过量的NaOH溶液: Ca2++HCO3―+OH―=CaCO3↓+H2O |
| B.NaHSO4溶液与Ba(OH)2溶液混合后显酸性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C.FeI2溶液中通入少量Cl2:2 Fe2+ + Cl2="2" Fe3+ + 2Cl- |
| D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰使SO42-沉淀完全NH4++Al3++2Ba2++2SO42-+4OH- =Al(OH)3↓+NH3·H2O+2BaSO4↓ |
常温下,下列各组离子在指定溶液中能大量共存的是 ( )
| A.由水电离的c(H+)=10-4mol/L的溶液中:Fe2+、SO42—、K+、NO3— |
| B.由水电离的c(H+)=10-14mol/L的溶液中:Ca2+、Na+、HCO3—、NO3— |
| C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、SO42—、Cl— |
| D.c(Fe3+)=0.1mol/L的溶液中:Na+、K+、NO3—、SO32— |
下列离子方程式正确的是
| A.向Ca(OH)2溶液中通入过量CO2:Ca2++2OH—+CO2=CaCO3↓+H2O |
| B.将盐酸溶液滴加到石灰石中:CO32—+2H+=CO2↑+H2O |
| C.将少量H2SO4溶液滴加到Ba(OH)2溶液中:2H++SO42—+2OH—+Ba2+=BaSO4↓+2H2O |
| D.将铁粉加入到AgNO3溶液中:Fe+Ag+=Ag+Fe2+ |
下列解释事实的离子方程式正确的是( )
| A.向明矾溶液中加入氢氧化钡溶液至沉淀质量最大Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
| B.向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++HCO3-+OH- =CaCO3↓+H2O |
C.用惰性电极电解MgCl2溶液:2Cl-+2H2O 2OH- +Cl2↑+ H2↑ 2OH- +Cl2↑+ H2↑ |
| D.NaClO溶液中通入少量的SO2:ClO-+H2O+SO2=Cl-+SO42-+2H+ |