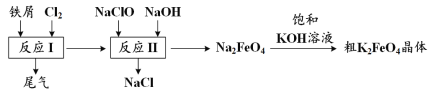题目内容
【题目】在2L的密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K300℃>K350℃,则该反应正反应是_______热反应。
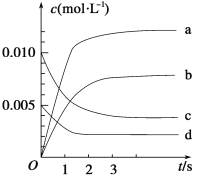
(2)如图表示NO2的变化的曲线是_________。用O2表示从0~2 s内该反应的平均速率v=_______ mol·L-1·s-1。
(3)能说明该反应已达到平衡状态的是____。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是____。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
【答案】放 b 1.5×10-3 bc c
【解析】
(1)根据温度对化学平衡移动的影响,结合化学平衡常数大小判断反应的热效应;
(2)根据表中数据计算平衡时NO、NO2的物质的量,结合容器的体积判断物质的平衡浓度,从而确定NO2的曲线;先计算2s内NO的浓度变化计算从02s内该反应的平均速率v(NO),然后根据同一反应中同一段时间内各物质的反应速率之比等于其计量数之比计算v(O2);
(3)根据反应达到平衡状态时各种物质的物质的量、浓度及物质的含量不变判断平衡状态;
(4)根据平衡移动原理分析。
(1)化学平衡常数K300℃>K350℃,说明升高温度,化学平衡逆向移动,由于在其他条件不变时,升高温度,化学平衡向吸热反应方向移动,逆反应方向为吸热反应,则该反应正反应是放热反应。
(2)根据表中数据知,达到平衡状态时n(NO)=0.007mol,则参加反应的 n(NO)=(0.020-0.007)mol=0.013mol,反应开始时c(NO2)=0,根据N原子守恒可知,生成的n(NO2)=0.013mol,c(NO2)= 0.013mol ÷2L =0.0065mol/L;所以表示NO2的变化的曲线是b;从02s内该反应的平均速率v(NO)= 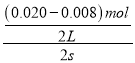 =0.003mol/(L·s),同一反应中同一段时间内各物质的反应速率之比等于其计量数之比,则v(O2)=
=0.003mol/(L·s),同一反应中同一段时间内各物质的反应速率之比等于其计量数之比,则v(O2)=![]() v(NO)= 0.0015mol/(L·s)= 1.5×10-3 mol/(L·s);
v(NO)= 0.0015mol/(L·s)= 1.5×10-3 mol/(L·s);
(3)a.无论反应是否达到平衡状态都存在v(NO2)=2v(O2),不能据此判 断平衡状态,a错误;
b.反应前后气体物质的量改变,则容器压强改变,当容器内压强保持不变时,正、逆反应速率相等,反应达到平衡状态,b正确;
c.v逆(NO)=2v正(O2),正、逆反应速率相等,反应达到平衡状态,c正确;
d.无论反应是否达到平衡状态,容器内密度始终保持不变,不能据此判断平衡状态,d错误; 故合理选项是bc;
(4)a.及时分离出NO2 气体,生成物浓度减小,则化学反应速率减小,a错误;
b.适当升高温度,增大活化分子百分数,化学反应速率增大,由于该反应的正反应为放热反应,升高温度,平衡逆向移动,b错误;
c.增大O2的浓度,增大单位体积内活化分子个数,化学反应速率增大,由于O2是反应物,增大反应物的浓度,平衡正向移动,c正确;
d.选择高效催化剂,增大活化分子百分数,化学反应速率增大,但催化剂不能使化学平衡发生移动,d错误;
故合理选项是c。

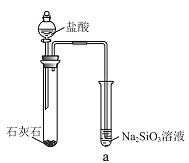
【题目】硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:下列结论不正确的是( )
编号 | Ⅰ | Ⅱ |
实验 |
|
|
现象 | a 中产生凝胶状沉淀 | b 中凝胶状沉淀溶解,c 中无明显变化 |
A.Na2SiO3溶液一定显碱性
B.由Ⅰ能说明酸性H2CO3>H2SiO3
C.由Ⅱ可知,同浓度时Na2CO3溶液的碱性强于NaHCO3溶液
D.向Na2SiO3溶液中通入少量CO2,发生反应:SiO32-+CO2+H2O=CO32-+H2SiO3↓
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积/mL | 浓度(mol/L) | 体积/mL | ||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4)∶n(KMnO4) ______________。
(2)探究温度对化学反应速率影响的实验编号是_______ (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是 ________.
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______。