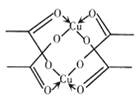
题目内容
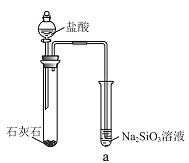
【题目】硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:下列结论不正确的是( )
编号 | Ⅰ | Ⅱ |
实验 |
|
|
现象 | a 中产生凝胶状沉淀 | b 中凝胶状沉淀溶解,c 中无明显变化 |
A.Na2SiO3溶液一定显碱性
B.由Ⅰ能说明酸性H2CO3>H2SiO3
C.由Ⅱ可知,同浓度时Na2CO3溶液的碱性强于NaHCO3溶液
D.向Na2SiO3溶液中通入少量CO2,发生反应:SiO32-+CO2+H2O=CO32-+H2SiO3↓
【答案】B
【解析】
A.硅酸钠为强碱弱酸盐,SiO32-的水解使得硅酸钠溶液显碱性,故A正确;
B.盐酸与石灰石反应生成二氧化碳,同时挥发出氯化氢,氯化氢也能与硅酸钠反应生成硅酸沉淀,所以由Ⅰ不能说明酸性H2CO3>H2SiO3,故B错误;
C.b 中凝胶状沉淀溶解,c 中无明显变化,说明b碱性更强,即同浓度时 Na2CO3溶液的碱性强于 NaHCO3溶液,故C正确;
D.Na2SiO3溶液中通入少量CO2,反应生成碳酸钠和硅酸,发生反应的离子方程式为:SiO32-+CO2+H2O=CO32-+H2SiO3↓,故D正确;
故答案为B。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】在2L的密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K300℃>K350℃,则该反应正反应是_______热反应。
(2)如图表示NO2的变化的曲线是_________。用O2表示从0~2 s内该反应的平均速率v=_______ mol·L-1·s-1。
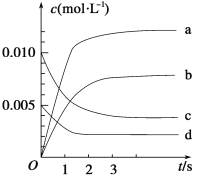
(3)能说明该反应已达到平衡状态的是____。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是____。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂