题目内容
【题目】有效去除废水中的H2SiF6、F-,改善水质是环境部门的重要研究课题。
(1)AlF3是有机合成中常用催化剂,利用废水中的H2SiF6可转变制得,相关热化学方程式如下:
3H2SiF6(aq)+2Al(OH)3(s)=Al2(SiF6)3(aq)+6H2O(l);ΔH=akJ·mol-1
Al2(SiF6)3(aq)+6H2O(l)=2AlF3(aq)+3SiO2(s)+12HF(aq);ΔH=bkJ·mol-1
3HF(aq)+Al(OH)3(s)=AlF3(aq)+3H2O(l);ΔH=ckJ·mol-1
则反应H2SiF6(aq)+2Al(OH)3(s)=2AlF3(aq)+SiO2(s)+4H2O(l)的ΔH=___kJ·mol-1。
(2)废水的酸碱度及废水中的Fe3+对F-浓度的测定都会产生一定的影响。
①测定时,通常控制废水的pH在5~6之间。pH过小所测F-浓度偏低,其原因是___。
②Fe3+与柠檬酸根(C6F5O73-)、F-反应可表示为Fe3++nC6H5O73-![]() Fe(C6H5O7)n(3n-3)-、Fe3++nF-
Fe(C6H5O7)n(3n-3)-、Fe3++nF-![]() FeFn(3-n)。向含有Fe3+的含氟废水中加入柠檬酸钠(C6H5O7Na3)可消除Fe3+对F-测定的干扰,其原因是___。
FeFn(3-n)。向含有Fe3+的含氟废水中加入柠檬酸钠(C6H5O7Na3)可消除Fe3+对F-测定的干扰,其原因是___。
(3)利用聚苯胺可吸附去除水中F-。用惰性电极电解苯胺(![]() )和盐酸的混合液可在阳极获得聚苯胺薄膜,变化过程为:
)和盐酸的混合液可在阳极获得聚苯胺薄膜,变化过程为:
![]()
写出阳极生成二聚体的电极反应式:___。
(4)利用MgCO3、Ca(OH)2和CaCO3等可沉淀去除废水中F-。
①以MgCl2溶液、尿素[CO(NH2)2]为原料可制得MgCO3,写出该反应的化学方程式:___。
②取三份相同的含F-的酸性废水,分别加入足量的MgCO3、Ca(OH)2和CaCO3。相同时间后溶液的pH及F-残留量如图1所示。实际废水处理过程中常选用MgCO3的优点除了F-残留率比较低之外,还有___。
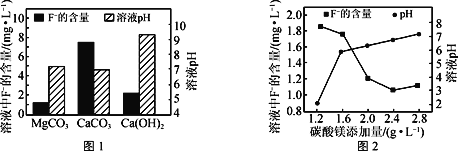
③改变碳酸镁添加量,处理后废水中F-含量及溶液pH的变化如图2所示。添加量超过2.4g·L-1后,溶液pH增大,使少量MgF2转化为Mg(OH)2,F-含量略有升高,此时溶液中的![]() =___。(已知:Ksp(MgF2)=8.0×10-11,Ksp[Mg(OH)2]=5.0×10-12)
=___。(已知:Ksp(MgF2)=8.0×10-11,Ksp[Mg(OH)2]=5.0×10-12)
【答案】![]() pH过小,H+与F-转化为弱酸HF Fe3+与柠檬酸根(C6H5O73-)的结合能力强于其与F-的结合能力 2
pH过小,H+与F-转化为弱酸HF Fe3+与柠檬酸根(C6H5O73-)的结合能力强于其与F-的结合能力 2![]() -2e-=
-2e-=![]() +2H+ MgCl2+CO(NH2)2+2H2O=MgCO3↓+2NH4Cl 所得溶液接近中性 4
+2H+ MgCl2+CO(NH2)2+2H2O=MgCO3↓+2NH4Cl 所得溶液接近中性 4
【解析】
(1)根据盖斯定律进行计算;
(2)①pH过小氢离子浓度大,结合氟离子,所测F-浓度偏低;
②Fe3+与柠檬酸根(C6H5O73-)的结合减少了与氟离子的结合;
(3)用惰性电极电解苯胺(![]() )和盐酸的混合液可在阳极获得聚苯胺薄膜,苯胺失电子生成二聚体,结合电子守恒、电荷守恒、原子守恒写出电极反应;
)和盐酸的混合液可在阳极获得聚苯胺薄膜,苯胺失电子生成二聚体,结合电子守恒、电荷守恒、原子守恒写出电极反应;
(4)①以MgCl2溶液、尿素[CO(NH2)2]为原料可制得MgCO3和氯化铵,原子守恒配平书写化学方程式;
②分析柱状图可知取三份相同的含F-的酸性废水,分别加入足量的MgCO3、Ca(OH)2和CaCO3,相同时间内,碳酸镁处理后氟离子含量最少,溶液pH接近7;
③Ksp(MgF2)=c(Mg2+)·c2(F-)=8.0×10-11,Ksp[Mg(OH)2]= c(Mg2+)·c2(OH -),据此进行计算。
(1)①3H2SiF6(aq)+2Al(OH)3(s)═Al2(SiF6)3(aq)+6H2O(l)△H=a kJmol-1
②Al2(SiF6)3(aq)+6H2O(l)═2AlF3(aq)+3SiO2(s)+12HF(aq)△H=b kJmol-1
③3HF(aq)+Al(OH)3(s)═AlF3(aq)+3H2O(l)△H=c kJmol-1
盖斯定律计算(①+②+③×4)×![]() 得到反应H2SiF6(aq)+2Al(OH)3(s)═2AlF3(aq)+SiO2(s)+4H2O(l)的△H=
得到反应H2SiF6(aq)+2Al(OH)3(s)═2AlF3(aq)+SiO2(s)+4H2O(l)的△H=![]() kJ/mol。
kJ/mol。
(2)①测定时,通常控制废水的pH在5~6之间。pH过小所测F-浓度偏低,其原因是:pH过小,H+与F-转化为弱酸HF;
②Fe3+与柠檬酸根(C6H5O73-)的结合能力强于其与F-的结合能力。
(3)用惰性电极电解苯胺(![]() )和盐酸的混合液可在阳极获得聚苯胺薄膜,苯胺失电子生成二聚体,结合电子守恒、电荷守恒、原子守恒写出电极反应:
)和盐酸的混合液可在阳极获得聚苯胺薄膜,苯胺失电子生成二聚体,结合电子守恒、电荷守恒、原子守恒写出电极反应:![]() ;
;
(4)①以MgCl2溶液、尿素[CO(NH2)2]为原料可制得MgCO3和氯化铵,原子守恒配平书写化学方程式:MgCl2+CO(NH2)2+2H2O═MgCO3↓+2NH4Cl;
②根据图示分析可知相同条件下,使用MgCO3处理后的废水中F-残留量最低,溶液接近中性,故答案为:所得溶液接近中性;
③Ksp(MgF2)=c(Mg2+)·c2(F-)=8.0×10-11,Ksp[Mg(OH)2]= c(Mg2+)·c2(OH -)=5×10-12,溶液中存在,MgF2(s)+2OH-(aq)=Mg(OH)2(s)+2F-(aq),则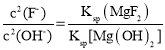 ,所以
,所以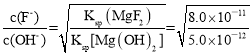 =4。
=4。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案