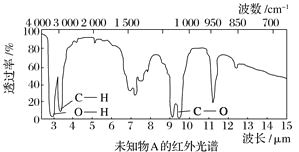
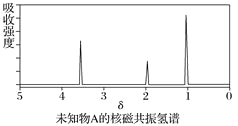
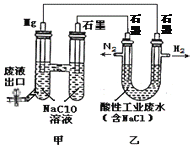
题目内容
【题目】在25℃时,用蒸馏水稀释1mol·L-1的氨水至0.01mol·L-1,随着溶液的稀释,下列各项比值中始终不变的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
【答案】A
【解析】
由电离方程式NH3H2O ![]() NH4++OH- 知:
NH4++OH- 知:
A、Kb=![]() ,温度不变,平衡常数不变,选项A正确;
,温度不变,平衡常数不变,选项A正确;
B、加水促进电离,c(NH4+)和c(OH-)都同等程度减小(不考虑水的电离),那么比值![]() 是不变的,选项B错误;
是不变的,选项B错误;
C、加水促进电离,则n(NH3H2O)减少,n(NH4+)增大,![]() 减小,选项C错误;
减小,选项C错误;
D、加水促进电离,平衡向右移动,c(NH3H2O)和c(OH-)都减小,但是由于在同一溶液中体积相同, n(NH3H2O)减小,而n(OH-)增大,故![]() 增大,选项D错误;
增大,选项D错误;
答案选A。

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
【题目】一定温度时,向2.0L恒容密闭容器中充入2molSO2和1mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前2s的平均速率v(O2)=0.2mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.相同温度下,起始时向容器中充入4molSO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变向该容器中再充入2molSO2、1molO2,反应达到新平衡时![]() 增大
增大