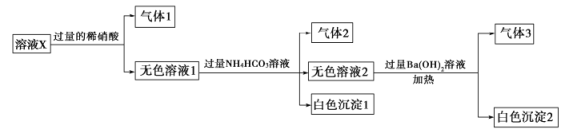
题目内容
【题目】如图装置闭合电键时,电流表A的指针将发生偏转。试回答下列问题。

(1)A池是________,Zn的电极名称是________;B池是________,Pt的电极名称是________。
(2)写出下列有关反应:
Zn极上电极反应:___________________________________________;
Pt极上电极反应:___________________________________________。
(3)B池中的总反应的化学方程式为_________________________________。
(4)如果要用B池给铁片上镀上一层Cu,则B池应作何改进___________________________。
【答案】原电池 负 电解池 阳 Zn-2e-=Zn2+ 2H2O- 4e- =4H++ O2↑ 2CuSO4 + 2H2O![]() 2Cu + O2↑+ 2H2SO4 Pt换成Cu,C换成Fe
2Cu + O2↑+ 2H2SO4 Pt换成Cu,C换成Fe
【解析】
左侧装置是原电池,锌是负极,铜是正极,右侧装置是电解池,据此解答。
(1)金属性最强的Zn在A池,则A池形成原电池,Zn失去电子,作负极; B池是电解池,Pt的电极与正极相连作阳极。答案为:原电池;负;电解池;阳;
(2)Zn极上,电极反应式为Zn - 2e-=Zn2+;Pt极上,硫酸铜溶液中的水失去电子,电极反应式为2H2O- 4e-=4H++ O2↑。;
(3)B池中的总反应为电解硫酸铜的水溶液,电池总反应为2CuSO4 + 2H2O![]() 2Cu + O2↑+ 2H2SO4;
2Cu + O2↑+ 2H2SO4;
(4)如果要用B池给铁片上镀上一层Cu,则阳极Pt换成Cu,阴极C换成Fe。答案为:Pt换成Cu,C换成Fe。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂,实验室制取POCl3并测定产品含量的实验过程如下:
I.制备POCl3采用氧气氧化液态的PCl3法。实验装置(加热及夹持装置省略》及相关信息如下。

物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | ―112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈 水解为含氧酸和氯化氢,两者互溶 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)仪器a的名称为_______________________________;
(2)装置C中生成POCl3的化学方程式为________________________________;
(3)实验中需控制通入O2的速率,对此采取的操作是_________________________________;
(4)装置B的作用除观察O2的流速之外,还有___________________________________;
(5)反应温度应控制在60~65℃,原因是__________________________________;
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.5mol/L AgNO3标准溶液(Ag++Cl-=AgCl↓)
③加入少量硝基苯(硝基苯密度比水大,且难溶于水)
④以硫酸铁溶液为指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液(Ag++SCN-=AgSCN↓),到达终点时共用去10.00mL KSCN溶液。
(6)达到终点时的现象是_________________________________________;
(7)测得产品中n(POCl3)= ___________________________;
(8)已知Ksp(AgCl)> Ksp(AgSCN),据此判断,若取消步骤③,滴定结果将_______。(填偏高,偏低,或不变)