题目内容
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
电离能 | I1 | I2 | I3 | I4 | I5 |
电离能/(kJ·mol-1) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是________价,其基态原子电子排布式为________________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为________________。
(3)PO43-的中心原子的杂化方式为________,该离子的空间构型为________,键角为________,其等电子体有________(请写出两种)。
(4)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为________,原因为__________________。
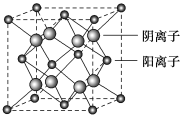
(5)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为________;已知Ca2+和F-半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________ g·cm-3(不必化简)。
【答案】+2 [Ar]4s2或1s22s22p63s23p64s2 F>O>P sp3 正四面体形 109°28′ SO42-、CCl4等 MgO>CaO Mg2+半径比Ca2+小,晶格能较大 12 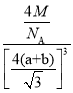
【解析】
(1)根据元素M的气态原子的第I1至I5电离能大小可以看出:I1、I2相差不大,I2、I3电离能相差较多,说明M原子最外层有2个电子。在Ca5(PO4)3中元素有Ca、P、O三种元素,只有钙元素最外层有2个电子,原子半径大,容易失去最外层的2个电子,化合价为+2价;根据原子核外电子排布规律可知Ca基态原子电子排布式为[Ar]4s2或1s22s22p63s23p64s2。
(2)Ca3(PO4)3F中非金属元素为F、O、P,三者的非金属性F>O>P,电负性与非金属性强弱关系一致,所以电负性由大到小的顺序为F>O>P;
(3)PO43-的中心原子P的价层电子对数是4,故磷原子杂化为sp3杂化;由于孤对电子对数为0,该离子的空间构型为正四面体形,键角为109°28′,原子数和价电子数分别都相等的是等电子体,其等电子体有SO42-、CCl4。答案为:sp3;正四面体形;109°28′;SO42-、CCl4等;
(4)已知MgO与CaO的晶体结构相似,Mg2+与Ca2+带电荷相同,但半径Mg2+比Ca2+小,晶格能大,所以其摩氏硬度的大小关系为MgO>CaO,原因为Mg2+半径比Ca2+小,晶格能较大。答案为:MgO>CaO;Mg2+半径比Ca2+小,晶格能较大;
(5)根据CaF2晶胞结构可知:在每个晶胞中与Ca2+距离最近且等距离的Ca2+有3个,通过每个Ca2+可形成8个晶胞,每个Ca2+计算了2次,所以与Ca2+距离最近且等距离的Ca2+有(3×8)÷2=12个;在CaF2晶胞中,共含有4个“CaF2”,将CaF2晶胞分成8个小正方体,正方体中心为F-,顶点为Ca2+,晶胞中共有4个钙离子、8个氟离子。Ca2+与F-的最近核间距(a+b)为晶胞体对角线的![]() 。故晶胞边长为
。故晶胞边长为![]() 。根据
。根据![]() =4M,可求晶体密度
=4M,可求晶体密度![]() =
=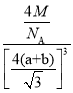 g·cm-3。答案为:12;
g·cm-3。答案为:12;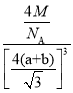 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案