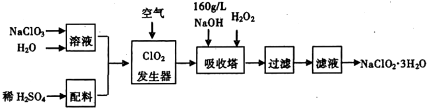
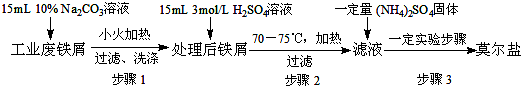
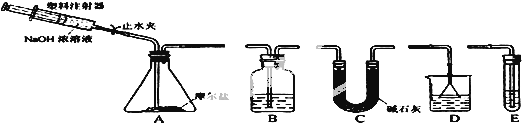
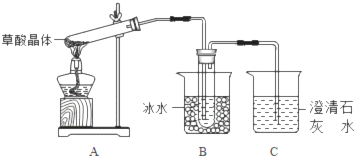
题目内容
14.在浓度均为0.1mol/L的Na2CO3和NaHCO3的混合溶液中,下列关系正确的是( )| A. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | c(Na+)-[c(CO32-)+c(HCO3-)]=c(OH-)-c(H+) | |
| C. | c(Na+):[c(CO32-)+c(HCO3-)+c(H2CO3)]=2:3 | |
| D. | c(HCO3-)+2c(H+)+3c(H2CO3)=c(CO32-)+2c(OH-) |
分析 任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),根据物料守恒得c(Na+):[c(CO32-)+c(HCO3-)+c(H2CO3)]=3:2,该溶液中CO32-水解程度大于HCO3-,据此分析解答.
解答 解:A.CO32-水解程度大于HCO3-,则c(CO32-)<c(HCO3-),故A错误;
B.根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),所以c(Na+)-[2c(CO32-)+c(HCO3-)]=c(OH-)-c(H+),故B错误;
C.根据物料守恒得c(Na+):[c(CO32-)+c(HCO3-)+c(H2CO3)]=3:2,故C错误;
D.根据物料守恒得2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)]、根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),所以得c(HCO3-)+2c(H+)+3c(H2CO3)=c(CO32-)+2c(OH-),故D正确;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中存在的电荷守恒、物料守恒是解本题关键,注意:该溶液中CO32-水解程度大于HCO3-导致溶液中c(CO32-)<c(HCO3-),易错选项是A.

练习册系列答案
相关题目
2.下列各组的两种物质作用时,反应条件或反应物用量的改变,对产物没有影响的是( )
| A. | Na2O2和H2O | B. | Na和O2 | C. | Ca(OH)2和CO2 | D. | C和O2 |
19.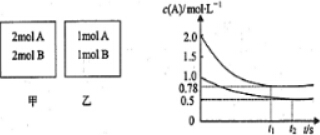 向甲乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法正确的是( )
向甲乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法正确的是( )
 向甲乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法正确的是( )
向甲乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法正确的是( )| A. | x可能等于1也可能等于2 | |
| B. | 向平衡后的乙容器中充入氮气可使c(A)增大 | |
| C. | 将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同 | |
| D. | 温度不变,向甲容器中再充入2mol A、2mol B,平衡时甲容器中c(A)=1.0mol•L-1 |
6.下列无水氯化物中不能用氯气和该元素的单质直接化合制取的是( )
| A. | AlCl3 | B. | CuCl2 | C. | FeCl2 | D. | HCl |
3.NA代表阿伏加德罗常数的值下列有关叙述正确的是( )
| A. | 5.6g铁粉在2.24L氯气中充分燃烧,失去的电子数一定为0.3NA | |
| B. | 标准状况下,15g一氧化氮和5.6L氧气混合后的分子总数为0.5NA | |
| C. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA | |
| D. | 78gNa2S和Na2O2的混合物中含有的离子总数大于3NA |
4.NA表示阿伏加德罗常数,下列说法错误的是( )
| A. | 5.6gFe与Br2完全反应,转移电子数为0.3NA | |
| B. | 常温常压下,3.2gO3所含的氧原子数为0.2NA | |
| C. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和小于0.1NA | |
| D. | 常温常压下,22.4LO2所含的原子数为2NA |