题目内容
3.NA代表阿伏加德罗常数的值下列有关叙述正确的是( )| A. | 5.6g铁粉在2.24L氯气中充分燃烧,失去的电子数一定为0.3NA | |
| B. | 标准状况下,15g一氧化氮和5.6L氧气混合后的分子总数为0.5NA | |
| C. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA | |
| D. | 78gNa2S和Na2O2的混合物中含有的离子总数大于3NA |
分析 A.氯气所处的状态不明确;
B.标准状况下,1mol任何气体中含有的分子数为1NA;
C.先计算甲烷和水的物质的量,再计算出电子数进行比较;
D.Na2S和Na2O2摩尔质量相同,过氧化钠是有钠离子和过氧根离子构成;
解答 解:A.氯气所处的状态不明确,故2.24L氯气的物质的量不一定是0.1mol,故A错误;
B.标准状况下,15g(0.5mol)一氧化氮和5.6L(0.25mol)氧气混合后发生反应生成0.5mol的二氧化氮,但生成的二氧化氮又能生成四氧化二氮,二者的反应为可逆反应,则分子的总物质的量小于0.5mol,分子数小于0.5NA,故B错误;
C.标况下,22.4L甲烷的物质的量是1mol,含有10mol电子,18g水物质的量是1mol,含有10mol电子,所含有的电子数均为10NA,故C正确;
D.Na2S和Na2O2摩尔质量相同,过氧化钠是有钠离子和过氧根离子构成;7.8g Na2S和Na2O2的混合物物质的量为0.1mol,含有的阳离子数为0.2NA,阴离子数0.1NA,含有的离子总数等于3NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意过氧化钠中阴离子是过氧根离子,注意气体摩尔体积的使用对象和条件,题目难度不大.

练习册系列答案
相关题目
14.在浓度均为0.1mol/L的Na2CO3和NaHCO3的混合溶液中,下列关系正确的是( )
| A. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | c(Na+)-[c(CO32-)+c(HCO3-)]=c(OH-)-c(H+) | |
| C. | c(Na+):[c(CO32-)+c(HCO3-)+c(H2CO3)]=2:3 | |
| D. | c(HCO3-)+2c(H+)+3c(H2CO3)=c(CO32-)+2c(OH-) |
11.下列说法中正确的是( )
| A. | 将342g 蔗糖(C12H22O11)溶于1L水中,所得溶液的物质的量浓度为1mol/L | |
| B. | 将1L2mol/L H2SO4溶液加水稀释到2L,所得溶液的物质的量浓度为1mol/L | |
| C. | 将1L 8.4 mol/L的H2SO4溶液加入到1L水中,所得溶液的物质的量浓度为9.2mol/L | |
| D. | 将336mL HCl气体溶于水,配成300 mL溶液,所得溶液的物质的量浓度为0.05mol/L |
18.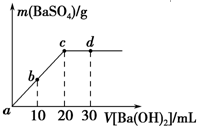 常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )
常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )
 常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )
常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )| A. | 硫酸溶液的体积为20mL | |
| B. | b时刻溶液中SO${\;}_{4}^{2-}$的浓度约为0.083mol•L-1 | |
| C. | d时刻溶液的pH为12 | |
| D. | 反应的离子反应方程式为Ba2++SO4-+2H++2OH-═BaSO4↓+2H2O |
8.多选题:下列关于实验的操作、原理的叙述,正确的是 ( )
| A. | 硫酸亚铁铵晶体过滤后用无水乙醇洗涤,阿司匹林晶体过滤后用水洗涤 | |
| B. | 牙膏中的安息香酸钠、氟化钠等溶于水,水解使溶液显酸性 | |
| C. | 要在溶液中将MnO4-完全转化为Mn2+,可向酸性KMnO4溶液中滴加H2O2溶液至紫色完全消失 | |
| D. | 用盐析的方法从油脂皂化反应的混合液中分离出高级脂肪酸钠 | |
| E. | 用蒸馏的方法除去Na+、SO42-、Cl-等杂质 |
15.下列各组离子在透明溶液中能大量共存的是( )
| A. | K+、Cu2+、Na+、Cl- | B. | H+、Na+、NO3-、CO32- | ||
| C. | Ba2+、H+、NO3-、SO42- | D. | Mg2+、Na+、OH-、SO42- |
12.标准状况下,33.6L CO、H2混合气体的质量比为49:4,则CO、H2的体积分别为( )
| A. | 11.2L,22.4L | B. | 15.68L,17.92L | C. | 13.44L,20.16L | D. | 16.8L,16.8L |
13.下列说法正确的是( )
| A. | 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| B. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═SO32-+2I-+4H+ | |
| C. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |