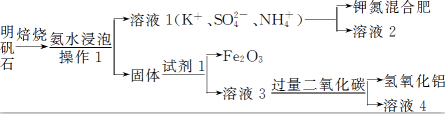
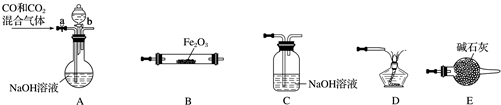
题目内容
4.NA表示阿伏加德罗常数,下列说法错误的是( )| A. | 5.6gFe与Br2完全反应,转移电子数为0.3NA | |
| B. | 常温常压下,3.2gO3所含的氧原子数为0.2NA | |
| C. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和小于0.1NA | |
| D. | 常温常压下,22.4LO2所含的原子数为2NA |
分析 A.铁与溴反应生成溴化铁,依据完全反应的物质的量计算转移电子数目;
B.臭氧是由氧原子构成,依据n=$\frac{m}{M}$计算氧原子的物质的量;
C.碳酸氢根离子水解生成碳酸,依据物料守恒解答;
D.常温常用Vm≠22.4L/mol.
解答 解:A.5.6gFe物质的量为0.1mol与Br2完全反应生成0.1mol溴化亚铁,转移电子数0.3NA,故A正确;
B.臭氧是由氧原子构成,3.2gO3所含的氧原子物质的量为$\frac{3.2g}{16g/mol}$=0.2mol,所含的氧原子数为0.2NA,故B正确;
C.1L 0.1mol•L-1的NaHCO3溶液中H2CO3、HCO3-和CO32-离子数之和等于0.1NA,所以HCO3-和CO32-离子数之和小于0.1NA,故C正确;
D.常温常用Vm≠22.4L/mol,Vm未知,无法计算22.4LO2所含的原子数,故D错误;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意气体摩尔体积使用条件和对象,判断盐溶液中离子浓度,注意对物料守恒的应用,题目难度不大.

练习册系列答案
相关题目
14.在浓度均为0.1mol/L的Na2CO3和NaHCO3的混合溶液中,下列关系正确的是( )
| A. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | c(Na+)-[c(CO32-)+c(HCO3-)]=c(OH-)-c(H+) | |
| C. | c(Na+):[c(CO32-)+c(HCO3-)+c(H2CO3)]=2:3 | |
| D. | c(HCO3-)+2c(H+)+3c(H2CO3)=c(CO32-)+2c(OH-) |
15.下列各组离子在透明溶液中能大量共存的是( )
| A. | K+、Cu2+、Na+、Cl- | B. | H+、Na+、NO3-、CO32- | ||
| C. | Ba2+、H+、NO3-、SO42- | D. | Mg2+、Na+、OH-、SO42- |
12.标准状况下,33.6L CO、H2混合气体的质量比为49:4,则CO、H2的体积分别为( )
| A. | 11.2L,22.4L | B. | 15.68L,17.92L | C. | 13.44L,20.16L | D. | 16.8L,16.8L |
9.下列关于铁电极的说法中,正确的是( )
| A. | 钢铁的吸氧腐蚀中铁是正极 | |
| B. | 在铁片上镀铜时铁片作阳极 | |
| C. | 电解饱和食盐水时可用铁作阴极 | |
| D. | 镀锌铁板发生电化学腐蚀时铁是负极 |
13.下列说法正确的是( )
| A. | 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| B. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═SO32-+2I-+4H+ | |
| C. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
14.下列各组物质在适宜条件下反应,其中氧化剂与还原剂的物质的量之比为2:1的是( )
| A. | H2SO4(浓)+C | B. | Fe2O3+Al | C. | HNO3(浓)+C | D. | Fe2O3+CO |