题目内容
9.乙二酸俗称草酸,其K1=5.4×10-2,K2=5.4×10-5.草酸和其盐存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐为难溶于水的白色沉淀.草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上发生分解.回答下列问题:
(1)①卤水豆腐和菠菜一起食用容易导致结石,卤水豆腐中含有可溶性钙盐,菠菜中含有草酸,写出导致结石的离子反应方程式Ca2++H2C2O4=CaC2O4↓+2H+.
②下列说法不正确的是D
A.向NaHCO3溶液中加入草酸溶液,若产生大量气泡则说明草酸的酸性比碳酸强
B.将等浓度的草酸和氢氧化钠溶液等体积混合,测反应后溶液的pH,若溶液呈酸性则说明草酸是二元酸
C.用已知浓度的氢氧化钠溶液滴定已知浓度的草酸,酚酞做指示剂,若消耗NaOH的物质的量近似是草酸的2倍则说明草酸是二元酸
D.向大量氯化钙溶液中滴入几滴碳酸钠溶液,再加入草酸钠溶液,利用此实验现象可以证明草酸钙
(2)①草酸晶体170℃以上发生分解,从元素组成和碳元素化合价分析:可能生成三种氧化物,则三种氧化物化学式为CO、CO2、H2O;也可能生成两一种氧化物和一种酸,则该酸化学式为HCOOH.
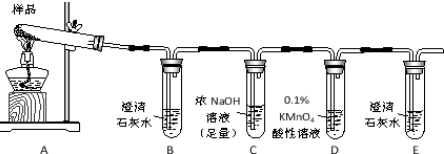
②事实表明,草酸晶体170℃以上分解产物为三种氧化物.甲组同学欲按照如图所示的装置进行实验,检验草酸晶体的分解产物.
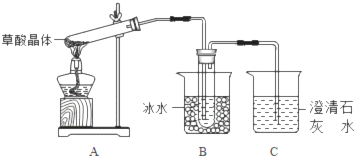
装置B的主要作用是冷却草酸蒸气,避免与澄清的石灰水作用产生白色沉淀,干扰二氧化碳的检出
装置C中可观察到的现象是有气泡冒出,澄清石灰水变浑浊
此装置的不足之处是没有尾气处理装置,不能检验CO、H2O
(3)碳元素的稳定价态为+4价,所以草酸具有还原性.
①草酸与酸性高锰酸钾溶液混合时,发现开始溶液颜色变化不明显,后来溶液迅速褪色,
解释原因
产生的MnSO4可作此反应的催化剂,导致后来反应突然加快
②测定某25ml草酸溶液的物质的量浓度,用amol/L酸性高锰酸钾溶液滴定,滴定终点消耗酸性高锰酸钾溶液Vml,写出计算草酸溶液物质的量浓度的表达式:(只列式不做任何计算,写出单位)$\frac{amol/L×VmL×\frac{5}{2}}{25mL}$
滴定终点的现象为滴入最后一滴高锰酸钾溶液时,溶液颜色恰好由无色变为紫红色且半分钟内不褪色.
分析 (1)①草酸为弱酸和钙离子反应生成草酸钙和氢离子;
②A.强酸能够制取弱酸,向NaHCO3溶液中加入草酸溶液,产生大量气泡说明有二氧化碳生成;
B.等浓度的草酸和氢氧化钠溶液等体积混合,若草酸为一元酸,两者恰好反应,测反应后溶液的pH,可确定草酸是否为二元酸;
C.酸碱中和的本质为氢离子和氢氧根离子反应生成水,恰好中和为氢离子物质的量等于氢氧根离子物质的量,消耗NaOH的物质的量近似是草酸的2倍,说明草酸是二元酸;
D.向大量氯化钙溶液中滴入几滴碳酸钠溶液,生成碳酸钙沉淀,再加入草酸钠溶液,沉淀不能说明是草酸钙沉淀;
(2)①碳的氧化物为CO、CO2,草酸晶体170℃以上发生分解,生成三种氧化物,化学式为CO、CO2、H2O,生成一种氧化物和一种酸,为HCOOH、CO2;
②B装置温度较低,有冷凝作用,冷凝(水蒸气和草酸),防止草酸进入装置C反应生成沉淀而干扰CO2的检验;草酸受热分解,分解时会产生二氧化碳而使澄清石灰水变浑浊;CO有毒不能排放到空气中,草酸受热分解,分解时会产生一氧化碳和水,不能检验;
(3)①根据浓度、温度、催化剂对化学反应速率的影响分析;
②草酸晶体滴入酸性高锰酸钾溶液发生氧化还原反应,2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O,根据反应方程式计算;
③滴定终点时,溶液由无色变成紫红色,且半分钟内不褪色.
解答 解:(1)①乙二酸俗称草酸,化学式为:H2C2O4,与豆腐中含有可溶性钙盐,反应生成草酸钙和氢离子反应为:Ca2++H2C2O4=CaC2O4↓+2H+,
故答案为:Ca2++H2C2O4=CaC2O4↓+2H+;
②A.向NaHCO3溶液中加入草酸溶液,若产生大量气泡,说明草酸能制取碳酸,根据强酸制弱酸原理,则说明草酸的酸性比碳酸强,故A正确;
B.将等浓度的草酸和氢氧化钠溶液等体积混合,两者溶质的物质的量相等,测反应后溶液的pH,若溶液呈酸性,说明酸过量,则草酸是二元酸,故B正确;
C.酸碱中和的本质为氢离子和氢氧根离子反应生成水,酚酞做指示剂,若消耗NaOH的物质的量近似是草酸的2倍,则说明等物质的量氢氧化钠和草酸,需消耗氢氧根离子是草酸物质的量的两倍,则草酸是二元酸,故C正确;
D.向大量氯化钙溶液中滴入几滴碳酸钠溶液,碳酸根离子和钙离子反应生成碳酸钙沉淀,再加入草酸钠溶液,不能说明草酸钙难溶,故D错误;
故答案为:D;
(2)①草酸晶体170℃以上发生分解,从元素组成和碳元素化合价分析:生成三种氧化物,反应为:HOOC-COOH$\frac{\underline{\;170℃\;}}{\;}$CO2↑+CO↑+H2O↑,三种氧化物,化学式为CO、CO2、H2O,生成两种氧化物和一种酸,反应为:HOOC-COOH$\frac{\underline{\;170℃\;}}{\;}$CO2↑+HCOOH,一种酸为HCOOH,
故答案为:CO、CO2、H2O;HCOOH;
②草酸易挥发,导致生成的气体中含有草酸,草酸和氢氧化钙反应生成难溶性的草酸钙而干扰二氧化碳的检验,B装置温度较低,有冷凝作用,冷凝(水蒸气和草酸),防止草酸进入装置C反应生成沉淀而干扰CO2的检验,
故答案为:冷却草酸蒸气,避免与澄清的石灰水作用产生白色沉淀,干扰二氧化碳的检出;
草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解,如果草酸受热分解,分解时会产生二氧化碳,二氧化碳和氢氧化钙反应生成难溶性的碳酸钙沉淀而使澄清石灰水变浑浊,所以C中观察到的现象是:有气泡冒出且澄清石灰水变浑浊,说明有二氧化碳生成,
故答案为:有气泡冒出,澄清石灰水变浑浊;
草酸晶体170℃以上发生分解,若按HOOC-COOH$\frac{\underline{\;170℃\;}}{\;}$CO2↑+CO↑+H2O↑,分解,生成的CO为有毒气体,不能直接排放到空气中,生成的一氧化碳和水无法检验,
故答案为:没有尾气处理装置,不能检验CO、H2O;
(3)①酸性高锰酸钾和草酸溶液在硫酸酸化条件下生成硫酸锰、硫酸钾等,化学反应方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,随着反应的进行,反应物浓度逐渐减小,化学反应速率减慢,因此不是浓度,反应放热导致温度升高,化学反应速率加快,催化剂可以加快化学反应速率,应为Mn2+对该反应起催化作用,
故答案为:产生的MnSO4可作此反应的催化剂,导致后来反应突然加快;
②酸性高锰酸钾和草酸溶液在硫酸酸化条件下生成硫酸锰、硫酸钾等,化学反应方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,设草酸溶液的物质的量浓度为Cmol/L,则
2KMnO4 ~5H2C2O4
2mol 5mol
aV×10-3mol 0.025L×c
C(H2C2O4)=$\frac{amol/L×VmL×\frac{5}{2}}{25mL}$
故答案为:$\frac{amol/L×VmL×\frac{5}{2}}{25mL}$;
③草酸溶液无色,滴定终点时,滴入最后一滴高锰酸钾溶液时,溶液颜色恰好由无色变为紫红色且半分钟内不褪色,
故答案为:滴入最后一滴高锰酸钾溶液时,溶液颜色恰好由无色变为紫红色且半分钟内不褪色.
点评 本题考查草酸的性质实验,侧重考查学生知识综合应用、实验基本操作能力,综合性较强,注意把握相关实验基本方法和注意事项,注意滴定中经常根据关系式进行计算,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 烧杯、酒精灯、试管、铁架台(铁圈)、漏斗 | |
| B. | 烧杯、漏斗、玻璃棒、铁架台(铁圈)、滤纸 | |
| C. | 滤纸、烧杯、试管夹、漏斗、玻璃棒 | |
| D. | 滤纸、试管、漏斗、铁架台(铁圈)、玻璃棒 |
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
| A. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | c(Na+)-[c(CO32-)+c(HCO3-)]=c(OH-)-c(H+) | |
| C. | c(Na+):[c(CO32-)+c(HCO3-)+c(H2CO3)]=2:3 | |
| D. | c(HCO3-)+2c(H+)+3c(H2CO3)=c(CO32-)+2c(OH-) |
| A. | Na与水反应时增大水的用量 | |
| B. | Al在氧气中燃烧生成Al2O3,将铝片改成铝粉 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| D. | Fe与硫酸反应制取H2时,选用浓硫酸 |
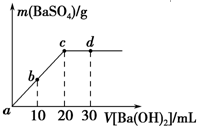 常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )
常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )| A. | 硫酸溶液的体积为20mL | |
| B. | b时刻溶液中SO${\;}_{4}^{2-}$的浓度约为0.083mol•L-1 | |
| C. | d时刻溶液的pH为12 | |
| D. | 反应的离子反应方程式为Ba2++SO4-+2H++2OH-═BaSO4↓+2H2O |