题目内容
6. 常见金属X,有下列关系图,根据图示回答:
常见金属X,有下列关系图,根据图示回答:(1)推断B溶液中肯定含有离子为Fe3+.
(2)写出X→A的反应方程式:Fe+2HCl═FeCl2+H2↑.
(3)产生红褐色沉淀的离子方程式:Fe3++3OH-═Fe(OH)3↓.
分析 金属X与盐酸反应生成A,A与Y反应生成B,而X与Y反应也生成B,B与NaOH反应反应得到红褐色沉淀,与KSCN溶液反应呈红色,则X为Fe、Y为Cl2、A为FeCl2、B为FeCl3,据此解答.
解答 解:金属X与盐酸反应生成A,A与Y反应生成B,而X与Y反应也生成B,B与NaOH反应反应得到红褐色沉淀,与KSCN溶液反应呈红色,则X为Fe、Y为Cl2、A为FeCl2、B为FeCl3.
(1)B与NaOH反应反应得到红褐色沉淀,与KSCN溶液反应呈红色,则B一定含有Fe3+,故答案为:Fe3+;
(2)X→A的反应方程式:Fe+2HCl═FeCl2+H2↑,故答案为:Fe+2HCl═FeCl2+H2↑;
(3)产生红褐色沉淀的离子方程式:Fe3++3OH-═Fe(OH)3↓,故答案为:Fe3++3OH-═Fe(OH)3↓.
点评 本题考查无机物推断,B与氢氧化钠溶液、KSCN溶液反应现象为推断突破口,注意对基础知识的理解掌握.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
17.下列说法不正确的是( )
| A. | 能量的释放或吸收是以发生变化的物质为基础的,二者密不可分,但以物质为主,如果物质没有变化,就不能引发能量的变化 | |
| B. | 氢能的优点是燃烧热值高,资源丰富,无毒无污染,且便于储存和运输,因此很可能成为未来的主要能源 | |
| C. | 对于在给定条件下反应物之间能够同时发生多个反应的情况,理想的催化剂还可以大幅度提高目标产物在最终产物中的比率 | |
| D. | 离子反应的速率决定于溶液中离子的浓度和离子的扩散速率,受温度影响不大,是一类不需要活化能来引发的反应,所以反应速率很高 |
14.下列说法中不正确的是( )
①将BaSO4放入水中不能导电,所以BaSO4是非电解质;
②氨溶于水得到的溶液能导电,所以氨水是电解质;
③固态的共价化合物不导电,熔融态的共价化合物可以导电;
④熔融的NaCl在电流作用下电离成Na+和Cl-;
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强;
⑥强电解质都是离子化合物,弱电解质都是共价化合物,
⑦强电解质的水溶液中不存在溶质分子.
①将BaSO4放入水中不能导电,所以BaSO4是非电解质;
②氨溶于水得到的溶液能导电,所以氨水是电解质;
③固态的共价化合物不导电,熔融态的共价化合物可以导电;
④熔融的NaCl在电流作用下电离成Na+和Cl-;
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强;
⑥强电解质都是离子化合物,弱电解质都是共价化合物,
⑦强电解质的水溶液中不存在溶质分子.
| A. | ①②③⑥ | B. | ①③⑤⑥⑦ | C. | ①②③④⑤⑥ | D. | 全部 |
18.对于下列反应的反应类型的判断,正确的是( )
| A. | CO2+H2O=H2CO3分解反应 | |
| B. | Cu(OH)2$\frac{\underline{\;△\;}}{\;}$CuO+H2O 化合反应 | |
| C. | Fe2O3+3CO$\frac{\underline{\;△\;}}{\;}$2Fe+3CO2 置换反应 | |
| D. | NaCl+AgNO3=AgCl↓+NaNO3复分解反应 |
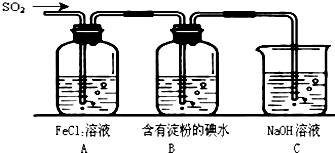 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示: