题目内容
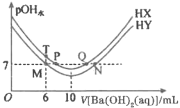
【题目】室温下,分别向体积均为20mL、浓度均为0.1mol/L的HX、HY溶液中滴加同浓度的Ba(OH)2溶液(Ba2+与X-、Y-均不反应)。已知pOH水![]() 水(OH-),
水(OH-),![]() 水(OH-)为反应后溶液中由水电离产生的氢氧根离子浓度。pOH水与滴加Ba(OH)2溶液的体积关系如图所示。下列说法不正确的是( )。
水(OH-)为反应后溶液中由水电离产生的氢氧根离子浓度。pOH水与滴加Ba(OH)2溶液的体积关系如图所示。下列说法不正确的是( )。
A.室温下,Ka(HX)>Ka(HY)
B.Q点溶液呈中性,溶液中c(X-)=2c(Ba2+)
C.T点溶液中阴离子浓度之和大于M点
D.室温下,水解常数Kh(Y-)=6.7×10-8
【答案】B
【解析】
A.Ba(OH)2溶液的体积为10mL时,分别与HX、HY溶液恰好反应生成BaX2、BaY2,由图可知等浓度的BaY2溶液的碱性强于BaX2溶液的,即Ka(HX)>Ka(HY),A正确;
B.曲线起点溶液呈酸性,最低点(拐点)溶液为碱性,继续滴加Ba(OH)2溶液碱性增强,Q、N点溶液为碱性,溶液中c(X-)<2c(Ba2+),B不正确;
C.T、M两点所加Ba(OH)2溶液体积均为6mL,所以两点的c(Ba2+)浓度相等,据电荷守恒:c(H+)+2c(Ba2+)=c(X-)+c(OH-)、c(H+)+2c(Ba2+)=c(Y-)+c(OH-),阴离子浓度之和即为阳离子浓度之和,M点为中性,T点为酸性,所以cM(H+)<cT(H+),显然,T点阴离子浓度之和大于M点,C正确;
D.M点为中性,据电荷守恒c(Y-)=2c(Ba2+)=![]() =
=![]() ,c(HY)=
,c(HY)=![]() =
=![]() ,Kh(Y-)=
,Kh(Y-)=![]()
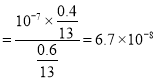 ,D正确;
,D正确;
故选B。

【题目】某小组探究Na2S溶液与KMnO4溶液反应,实验过程如下:
实验序号 | Ⅰ | Ⅱ |
实验过程 | 滴加6滴(约0.3mL)0.01mol/LNa2S溶液
| 滴加6滴(约0.3mL)0.01mol/L酸性KMnO4溶液(H2SO4酸化至pH=0)
|
实验现象 | 紫色变浅(pH<1),生成棕褐色沉淀(MnO2) | 溶液呈淡黄色(pH≈8),生成浅粉色沉淀(MnS) |
资料:ⅰ.![]() 在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
ⅱ.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
下列说法不正确的是( )。
A.根据实验可知,Na2S被氧化
B.取少量实验Ⅰ所得溶液进行实验,检测到有![]() ,不能说明S2-被
,不能说明S2-被![]() 氧化为
氧化为![]()
C.实验Ⅰ中生成棕褐色沉淀,说明酸性条件下S2-能将![]() 还原为MnO2
还原为MnO2
D.实验Ⅱ得到浅粉色沉淀,是由于S2-将新生成的![]() 还原为Mn2+并迅速与其结合所致
还原为Mn2+并迅速与其结合所致
【题目】氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是![]() 和
和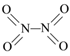 。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式_________________________
(2)对反应N2O4(g)![]() 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______
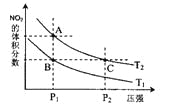
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_____mol·(L·s)-1。
②n3____n4(填“>”、“<”或“=”),该反应的平衡常数K的值为_____________,升高温度后,反应2NO2![]() N2O4的平衡常数K将_______(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将_______(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)