题目内容
【题目】C、N的氧化物常会造成一些环境问题,科研工作者用各种化学方法来消除这些物质对环境的影响。回答下列问题:
(1)CO2的重整:用CO2和H2为原料可得到CH4燃料。
已知:①![]()
②![]()
写出CO2重整的热化学方程式___________________________。
200℃时,向VL恒温密闭容器A(恒容)、B(恒压)中,均充入1molCO2和4molH2,两容器中反应达平衡时放出或吸收的热量较多的是_________________(填“A”或“B”)。
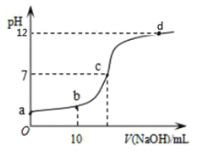
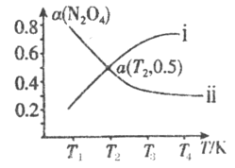
(2)在恒容密闭容器中充入一定量的N2O4,发生可逆反应![]() 。则N2O4的平衡转化率随温度的变化曲线为右图中的______________(填“i”或“ⅱ”)曲线。若T2K时容器的起始压强为102kPa,则该温度下反应的分压平衡常数Kp=_____________kPa。
。则N2O4的平衡转化率随温度的变化曲线为右图中的______________(填“i”或“ⅱ”)曲线。若T2K时容器的起始压强为102kPa,则该温度下反应的分压平衡常数Kp=_____________kPa。
(3)反应![]() ,在一定条件下,N2O4与NO2的消耗速率与各自的分压有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如右图所示。在T℃时,图中M,N点能表示该反应达到平衡状态,理由是__________________________________。改变温度,v(NO2)会由M点变为A,B或C,v(N2O4)会由N点变为D,E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为____________(填字母标号)。
,在一定条件下,N2O4与NO2的消耗速率与各自的分压有如下关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如右图所示。在T℃时,图中M,N点能表示该反应达到平衡状态,理由是__________________________________。改变温度,v(NO2)会由M点变为A,B或C,v(N2O4)会由N点变为D,E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为____________(填字母标号)。

(4)间接电化学法除NO,其原理如图所示。写出阴极的电极反应式(阴极室溶液呈酸性)_____________________,吸收池中除去NO的原理_______________(用离子方程式表示)。

【答案】![]() B i 204 M点
B i 204 M点![]() 的消耗速率是N点
的消耗速率是N点![]() 消耗速率的2倍,即
消耗速率的2倍,即![]() [或
[或![]() ] AD
] AD ![]()
![]()
【解析】
(1)根据盖斯定律进行计算;该反应是气体体积减小的反应,随着反应的进行,气体的压强会减小,为了保持恒压,容器的体积要减小;恒压(B)下的反应,相当于在恒容基础上将体积进行压缩,恒容条件的平衡会正向移动,据此分析热量的变化情况;
(2)由于该反应是吸热反应,随着温度的升高,平衡正向移动,N2O4的转化率增大,据此判断符合条件的曲线;根据压强之比和物质的量成正比的规律,可用压强代替物质的量列三段式进行计算,求出Kp;
(3)反应达到平衡后,正逆反应速率相等,且满足速率之比和系数成正比的规律;升高温度,化学反应速率会增加,变化后的点一定比M点、N点的速率要大,据此找到相应的变化的点;
(4)阴极得到电子发生还原反应,根据图可知是HSO3-在酸性条件下发生还原反应,生成S2O42-,据此写出其电极反应式;根据图示,吸收池中S2O42-和NO是反应物,N2和HSO3-是生成物,据此写出吸收池中除去NO反应的离子方程式。
(1)反应①-2×反应②可以得到目标反应,CO2(g)+4H2(g)=CH4(g)+2H2O(g),则△H=△H1-2×△H2=(247-2×205)kJ·mol-1=-163kJ·mol-1,则CO2重整的热化学方程式CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-163kJ·mol-1;该反应是气体体积减小的反应,随着反应的进行,气体的压强会减小,为了保持恒压,容器的体积要减小;恒压(B)下的反应,相当于在恒容基础上将体积进行压缩,恒容条件的平衡会正向移动,放出的热量会更多;
(2)由于该反应是吸热反应,随着温度的升高,平衡正向移动,N2O4的转化率增大,变化曲线为图中的ⅰ;若T2K时,容器的起始压强为102kPa。恒容条件下,压强之比等于物质的量之比,因此可用压强代替物质的量进行计算。T2K时,N2O4的平衡转化率为0.5,根据三段式,有:

则平衡常数![]() ;
;
(3)N2O4的消耗速率表示的为正反应速率,NO2的消耗速率表示的为逆反应速率;在同一个化学中,用不同的物质表示化学反应速率,其速率之比等于计量数之比。在T℃时,图中M点NO2的消耗速率是N点N2O4消耗速率的2倍,即v正(NO2)=v逆(NO2)[或v正(N2O4)=v逆(N2O4)]说明反应达到平衡;升高温度,化学反应速率会增加,则M点会变成A点;达到平衡时,NO2的消耗速率是新的点N2O4消耗速率的2倍,根据图示A点表示的反应速率是D点的两倍,则对应的点分别为A、D;
(4)阴极得到电子发生还原反应,根据图可知是HSO3-在酸性条件下发生还原反应,生成S2O42-,其电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O;根据图示,吸收池中S2O42-和NO是反应物,N2和HSO3-是生成物,则吸收池中除去NO的原理是2NO+2S2O42-+2H2O=N2+4HSO3-。

【题目】根据下列实验操作和现象得出的结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 将NaHCO3溶液滴入Ca(ClO)2溶液中 | 出现沉淀 | Ka2(H2CO3)> Ka (HClO) |
B | 将湿润的KI-淀粉试纸置于集满红棕色气体的集气瓶口 | 试纸变蓝 | 该气体为Br2 |
C | 将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液 | 出现沉淀 | 沉淀只有AgBr |
D | 将石蜡油蒸汽通过炽热的碎瓷片,再将生成的气体通入溴的CCl4溶液中 | 溶液褪色 | 石蜡油催化裂解生成不饱和烃 |
A.AB.BC.CD.D
【题目】某小组探究Na2S溶液与KMnO4溶液反应,实验过程如下:
实验序号 | Ⅰ | Ⅱ |
实验过程 | 滴加6滴(约0.3mL)0.01mol/LNa2S溶液
| 滴加6滴(约0.3mL)0.01mol/L酸性KMnO4溶液(H2SO4酸化至pH=0)
|
实验现象 | 紫色变浅(pH<1),生成棕褐色沉淀(MnO2) | 溶液呈淡黄色(pH≈8),生成浅粉色沉淀(MnS) |
资料:ⅰ.![]() 在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
ⅱ.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
下列说法不正确的是( )。
A.根据实验可知,Na2S被氧化
B.取少量实验Ⅰ所得溶液进行实验,检测到有![]() ,不能说明S2-被
,不能说明S2-被![]() 氧化为
氧化为![]()
C.实验Ⅰ中生成棕褐色沉淀,说明酸性条件下S2-能将![]() 还原为MnO2
还原为MnO2
D.实验Ⅱ得到浅粉色沉淀,是由于S2-将新生成的![]() 还原为Mn2+并迅速与其结合所致
还原为Mn2+并迅速与其结合所致