题目内容
11.将2.4g镁和铝的混合物粉末溶于75mL 4mol/L的盐酸中,反应一段时间后,再加入250mL 1.5mol/L的NaOH溶液后待反应完全,此时溶液中大量存在的是( )| A. | Na+、Mg2+ | B. | Na+、Al3+、Mg2+ | C. | Na+、Mg2+、[Al(OH)4]- | D. | Na+、[Al(OH)4]- |
分析 根据盐酸和氢氧化钠的物质的量相对大小确定混合溶液的酸碱性,再根据离子存在条件确定混合溶液中存在的离子,镁离子、铝离子存在于酸性或中性溶液中,偏铝酸根离子存在于碱性溶液中.
解答 解:n(HCl)=0.075L×4mol/L=0.3mol,n(NaOH)=0.25L×1.5mol/L=0.375mol>n(HCl),所以混合后的溶液呈碱性,镁离子和碱反应生成氢氧化镁沉淀,所以镁离子不能存在于碱性溶液中,铝元素在碱性溶液中以[Al(OH)4]-离子存在,钠离子在中性、酸性、碱性溶液中都存在,所以混合后的溶液中存在的离子是钠离子和[Al(OH)4]-离子,
故选D.
点评 本题考查了镁、铝的性质,明确离子存在的条件是解本题的关键,本题整体分析较简便.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案
相关题目
1.下列卤代烃一定能发生消去反应的是( )
| A. | 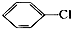 | B. | CH3CH2CH2Br | ||
| C. | 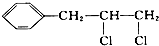 | D. | 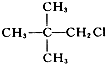 |
2.生活中的一些问题常涉及到化学知识,下列叙述不正确的是( )
| A. | 淀粉、纤维素、蛋白质都是天然有机高分子化合物 | |
| B. | 食用植物油的重要成分是高级不饱和脂肪酸甘油酯,不是天然高分子化合物 | |
| C. | 禁止使用含铅汽油是为了提高汽油的燃烧效率 | |
| D. | 碱液去污属于化学变化,洗涤剂去污主要是物理变化 |
19.两种物质不论以什么质量比混合,只要混合物的质量一定,充分燃烧时产生的水的量总为定值,这组混合物是( )
| A. | 乙炔和丁炔 | B. | 乙烷和丁烷 | C. | 苯和甲苯 | D. | 乙炔和苯 |
6.对于化学方程式SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,有关叙述正确的是( )
| A. | 反应中SiO2是氧化剂,C是还原剂 | |
| B. | 硅元素被还原了,碳元素被氧化了 | |
| C. | 在反应中C既是氧化剂又是还原剂 | |
| D. | 在反应中氧化剂与还原剂的物质的量之比为1:1 |
16.三联苯 的一氯代物有( ) 种同分异构体.
的一氯代物有( ) 种同分异构体.
 的一氯代物有( ) 种同分异构体.
的一氯代物有( ) 种同分异构体.| A. | 3 | B. | 4 | C. | 2 | D. | 5 |
3.下列说法正确的是( )
| A. | 分子式为C5H10的烃,属于烯烃和环烷烃的同分异构体(不包括顺反异构)的种类分别为5、4 | |
| B. | 分子式为C28H52的烯烃,分子中含有C=C双键的数目是4(不含环状结构) | |
| C. | 分子式为C3H5Cl的链状化合物(考虑顺反异构)的同分异构体共有3种 | |
| D. | 分子式为C3H6的有机物最多存在3个C-C单键,与C4H10的碳碳单键数相同 |
1.下列推断不正确的是( )
| A. | 稳定性:HF>HCl>HBr>HI | B. | 氧化性:I2>Br2>Cl2 | ||
| C. | 沸点:H2O>NH3 | D. | 还原性:HI>HBr>HCl>HF |
 W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.请回答下列问题:
W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.请回答下列问题: