题目内容
3.下列说法正确的是( )| A. | 分子式为C5H10的烃,属于烯烃和环烷烃的同分异构体(不包括顺反异构)的种类分别为5、4 | |
| B. | 分子式为C28H52的烯烃,分子中含有C=C双键的数目是4(不含环状结构) | |
| C. | 分子式为C3H5Cl的链状化合物(考虑顺反异构)的同分异构体共有3种 | |
| D. | 分子式为C3H6的有机物最多存在3个C-C单键,与C4H10的碳碳单键数相同 |
分析 A.C5H10可能是烯烃也可能是环烷烃,若为烯烃,①先写烷烃同分异构体(烷烃碳骨架)②主链从长到短、支链由整到散、位置由心到边③“C=C”位置移动;若为环烷烃,依次减少碳环中碳原子数,当为三元环时,考虑取代基异构(2个甲基或一个乙基);
B.烯烃C28H52与饱和烷烃相比少6个H原子,根据含有1个碳碳双键减少2个氢原子来解答;
C.C3H5C1含有一个双键,故可确定其碳骨架为C-C=C,然后根据氢原子的种类等于一氯代物的数目;
D.分子式为C3H6有机物中,环丙烷分子中含有的碳碳键最多,含有3个碳碳键;分子式为C4H10的有机物为丁烷,分子中也含有3个碳碳键.
解答 解:A.C5H10可能是烯烃也可能是环烷烃,戊烷的同分异构体有:CH3-CH2-CH2-CH2-CH3、 、
、 ;若为CH3-CH2-CH2-CH2-CH3,相应烯烃有2种:CH2═CH-CH2-CH2-CH3、CH3-CH═CH-CH2-CH3;若为
;若为CH3-CH2-CH2-CH2-CH3,相应烯烃有2种:CH2═CH-CH2-CH2-CH3、CH3-CH═CH-CH2-CH3;若为 ,相应烯烃有3种:CH2═C(CH3)CH2CH3;CH3C(CH3)═CHCH3;CH3CH(CH3)CH═CH2;若为
,相应烯烃有3种:CH2═C(CH3)CH2CH3;CH3C(CH3)═CHCH3;CH3CH(CH3)CH═CH2;若为 ,没有相应烯烃,所以分子式为C5H10的烯烃共有5种;
,没有相应烯烃,所以分子式为C5H10的烯烃共有5种;
若为环烷烃,五元环是环戊烷 ,四元环是甲基环丁烷
,四元环是甲基环丁烷 ,三元环时,存在1,2-二甲基环丙烷
,三元环时,存在1,2-二甲基环丙烷 ,乙基环丙烷
,乙基环丙烷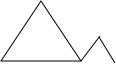 ,1,1-二甲基环丙烷
,1,1-二甲基环丙烷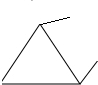 ,所以分子式为C5H10的环烷烃共有5种,故A错误;
,所以分子式为C5H10的环烷烃共有5种,故A错误;
B.烯烃C28H52与饱和烷烃相比少6个H原子,而含有1个碳碳双键减少2个氢原子,所以C28H52中含有的碳碳双键数为3,故B错误;
C.先不考虑Cl,写出C3H6的链状同分异构体,只有一种结构:CH3-CH=CH2,由于CH3-CH=CH2 只有三种氢,所以有三种一氯代物:CH2Cl-CH=CH2、CH3-CCl=CH2、CH3-CH=CHCl,其中CH3-CH=CHCl有顺式和反式两种结构.所以分子式为C3H5Cl链状有机物的同分异构体共有4种,故C错误;
D.分子式为C3H6有机物中,含有碳碳键最多的为环丙烷,环丙烷中含3个C-C单键,分子式为C4H10的有机物为丁烷,丁烷分子中也含有3个碳碳键,所以二者含有的碳碳单键数相同,故D正确;
故选D.
点评 本题考查同分异构体的书写,有机物结构的确定,难度中等,注意烯烃的同分异构体的书写方法,采取先写碳骨架异构、再移动C=C双键位置.

 出彩同步大试卷系列答案
出彩同步大试卷系列答案| A. | 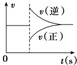 图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 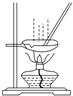 用图所示装置蒸发AlCl3溶液制备无水AlCl3 用图所示装置蒸发AlCl3溶液制备无水AlCl3 | |
| C. | 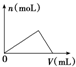 图可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化 图可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化 | |
| D. | 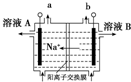 图电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B 图电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B |

| A. | 该分子中含有2种官能团 | |
| B. | 可与FeCl3溶液作用显紫色 | |
| C. | 1 mol莽草酸可与4 mol NaOH或2molBr2完全反应 | |
| D. | 在一定条件下,该物质既可发生加成反应也可发生取代反应 |
| A. | Na+、Mg2+ | B. | Na+、Al3+、Mg2+ | C. | Na+、Mg2+、[Al(OH)4]- | D. | Na+、[Al(OH)4]- |
| A. | 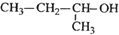 2-甲基-1-丙醇 2-甲基-1-丙醇 | B. |  3-乙基-1-丁烯 3-乙基-1-丁烯 | ||
| C. |  2-甲基-2,4-己二烯 | D. | 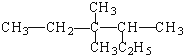 3,4,4-三甲基己烷 |
| A. | 16O与18O互为同素异形体 | |
| B. | 16O与18O核外电子排布方式不同 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 标准状况下,11.2L16O2和11.2L18O2均含NA个氧原子 |
(1)牙膏中添加甘油主要作用保温
为进一步炭疽牙膏中摩擦剂成分,进行了以下探究:
Ⅰ.摩擦剂成分的定性检验:
设计实验方案,验证假设,请写出实验步骤以及预期现象和结论(可不填满也可补充).可选的试剂:稀盐酸,稀硫酸,NaOH溶液,澄清石灰水.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量牙膏样品,加水充分搅拌、过滤 | 有难溶物存在 |
| 步骤2: | ①有无色气泡产生,说明有CaCO3 ②出现无色气泡,说明含有碳酸钙,说明有若有难溶物存在,说明有二氧化硅 |
| 步骤3: | |
| … |
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数

依据实验过程回答下列问题
(2)实验过程中需持续缓缓通入空气,其主要作用将生成的二氧化碳全部排入C中,使之完全被氢氧化钡吸收
(3)仪器C中选择Ba(OH)2而不选择Ca(OH)2溶液原因:①氢氧化钡的溶解度大,可以配制得较高的浓度②产物碳酸钡的相对分子量大,可以减小实验误差
(4)下列各项措施中,能提高测定准确经度的是ab(填标号)
a.在加入盐酸之前,应排净装置内的CO2气体
b.缓慢滴加稀盐酸
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)实验中准确称取1.00g样品三份,进行三次测定,测得BaCO2平均质量为3.94g,测样品中碳酸钙的质量分数为20%,若改测定C中生成BaCO2的质量分数,两方法测定的结果不同(填“相同”或“不同”),原因是B中的水蒸气、氯化氢气体等进入装置C中.
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
(1)CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4;但氨气分子间还存在氢键,则NH3的沸点高于PH3.
(2)CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是元素的非金属性越强,其氢化物的稳定性越强,分解温度越高.
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时HCl先液化.
 碳族元素的单质及其化合物是一类重要物质.请回答下列问题:
碳族元素的单质及其化合物是一类重要物质.请回答下列问题: ,其中碳氧原子之间共价键是c(填序号).
,其中碳氧原子之间共价键是c(填序号).