题目内容
10.合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500℃,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
| A. | 点e的正反应速率比点d的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不同 | |
| D. | 在给定条件下,t1、t2时刻NH3的含量相同 |
分析 A.e、d处于同一平衡状态;
B.c后氨气物质的量增大到不变,氢气物质的量减小到不变,则c点反应向正反应进行;
C.e、d两点处于同一平衡状态;
D.在给定条件下,t1、t2时刻处于同一平衡状态.
解答 解:A.e、d处于同一平衡状态,正反应速率相等,故A错误;
B.c后氨气物质的量增大到不变,氢气物质的量减小到不变,c点未到达平衡状态,反应向正反应进行,故B错误;
C.e、d两点处于同一平衡状态,n(N2)相同,故C错误;
D.在给定条件下,t1、t2时刻处于同一平衡状态,NH3的含量相同,故D正确,
故选:D.
点评 本题考查化学平衡图象、平衡状态建立,难度不大,注意理解化学平衡状态的特征.

练习册系列答案
相关题目
18.在一固定容积的密闭容器中加入2molX和3molY气体,发生如下反应:nX(g)+3Y(g)?2R(g)+Q(g)反应达到平衡时,测得X和Y的转化率分别为30%和60%,则化学方程式中的n值为 ( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
5. 一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g)+H2O (g)?CO2(g)+H2 (g)△H<0
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g)+H2O (g)?CO2(g)+H2 (g)△H<0
(1)在850℃时,CO和H2O浓度变化如图,则 0~4min的平均反应速率
v(CO2)=0.03mol•L-1•min-1
(2)t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
①计算t1℃该反应的平衡常数为 k=0.5,t1℃大于850℃(填“大于”、“小于”或“等于”).判断依据是:正反应为放热反应.
②t1℃时,反应在4min~5min间,平衡向左移动(填“向左”、“向右”或“不移动”),可能的原因是b.
a.增加CO的浓度 b.增加H2的浓度 c.加压 d.使用催化剂.
 一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g)+H2O (g)?CO2(g)+H2 (g)△H<0
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g)+H2O (g)?CO2(g)+H2 (g)△H<0(1)在850℃时,CO和H2O浓度变化如图,则 0~4min的平均反应速率
v(CO2)=0.03mol•L-1•min-1
(2)t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如表:
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②t1℃时,反应在4min~5min间,平衡向左移动(填“向左”、“向右”或“不移动”),可能的原因是b.
a.增加CO的浓度 b.增加H2的浓度 c.加压 d.使用催化剂.
15. 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是c;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.减少副产物乙醚生成 d.防止乙醇挥发
(2)在装置C中应加入b,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.浓硫酸 d.饱和碳酸氢钠溶液
(3)判断该制备实验实各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用a洗涤除去;(填正确选项前的字母)
a.氢氧化钠溶液 b.碘化钠溶液 c.水 d.Na2SO3溶液
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是c;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.减少副产物乙醚生成 d.防止乙醇挥发
(2)在装置C中应加入b,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.浓硫酸 d.饱和碳酸氢钠溶液
(3)判断该制备实验实各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用a洗涤除去;(填正确选项前的字母)
a.氢氧化钠溶液 b.碘化钠溶液 c.水 d.Na2SO3溶液
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
2.下列物质混合后,不会发生离子反应的是( )
| A. | NaOH溶液和FeCl3溶液 | B. | Na2CO3溶液和稀硫酸 | ||
| C. | CuSO4溶液和Ba(OH)2溶液 | D. | Na2SO4溶液和MgCl2溶液 |

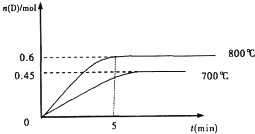 在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.试回答下列问题:
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.试回答下列问题: