题目内容
2.阅读下表中部分短周期主族元素的相关信息,请回答:| 元素代号 | 相关信息 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期的所有金属离子中,Y的离子半径最小 |
| Z | Z与Y同周期,是所在周期中原子半径最小的元素 |
| T | T的单质能与冷水剧烈反应,生成的强碱电离出两种电子数相等的阴、阳离子 |
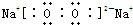 ,该化合物中所含的化学键有离子键、共价键(填化学键名称).
,该化合物中所含的化学键有离子键、共价键(填化学键名称).(2)单质T与冷水反应的化学方程式为2Na+2H2O═2NaOH+H2↑
(3)将T的最高价氧化物对应水化物的溶液逐滴加入到Y与Z形成的化合物的溶液中,直至过量(边滴加边振荡),写出此过程中发生反应的离子方程式Al3++4OH-═AlO2-+2H2O、Al3++3AlO2-+6H2O═4Al(OH)3↓.
分析 X的原子最外层电子数是其内层电子数的三倍,X有2个电子层,最外层电子数为6,则X为O元素;
在第三周期金属元素中,Y的简单离子半径最小,故Y为Al元素;
Z与Y同周期,是所在周期中原子半径最小的元素,则Z为Cl元素;
T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,T为Na元素,据此进行解答.
解答 解:X的原子最外层电子数是其内层电子数的三倍,X有2个电子层,最外层电子数为6,则X为O元素;在第三周期金属元素中,Y的简单离子半径最小,故Y为Al元素;Z与Y同周期,是所在周期中原子半径最小的元素,则Z为Cl元素;T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,T为Na元素,
(1)元素Na与O按原子个数比1:1形成的化合物B为Na2O2,过氧化钠为离子化合物,其电子式为: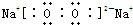 ,含有离子键、共价键,
,含有离子键、共价键,
故答案为: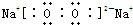 ;离子键、共价键;
;离子键、共价键;
(2)单质Na与冷水反应生成氢氧化钠和氢气,反应的化学方程式为:2Na+2H2O═2NaOH+H2↑,
故答案为:2Na+2H2O═2NaOH+H2↑;
(3)将Y与Z形成的化合物为氯化铝,T的最高价氧化物对应水化物为NaOH,将氯化铝逐滴加入到氢氧化钠溶液,边滴加边振荡,开始碱过量,反应生成偏铝酸钠与水,然后铝离子与偏铝酸根发生水解反应生成氢氧化铝沉淀,反应过程中离子方程式为:Al3++4OH-═AlO2-+2H2O、Al3++3AlO2-+6H2O═4Al(OH)3↓,
故答案为:Al3++4OH-═AlO2-+2H2O;Al3++3AlO2-+6H2O═4Al(OH)3↓.
点评 本题考查结构性质位置关系、化学用语、元素化合物的性质等知识,题目难度中等,合理推断各元素为解答关键,注意熟练掌握元素周期表结构、元素周期律内容.

 阅读快车系列答案
阅读快车系列答案| A. | 发现元素周期律 | B. | 提出分子学说 | C. | 提出原子学说 | D. | 提出电离学说 |
| A. | 如图所示的反应为吸热反应 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 需要加热才有发生的反应一定是吸热反应 | |
| D. | 化学键断裂吸收能量,化学键生成放出能量 |
| A. | 硫的原子结构示意图: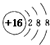 | |
| B. | NH4Br的电子式: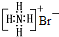 | |
| C. | Be2+离子中的质子数和电子数之比为2:1 | |
| D. | 中子数为146、原子序数为92的铀(U)原子:${\;}_{92}^{146}$U |
| A. | 某烷烃的结构为: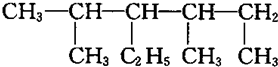 ,正确的命名是3,5-二甲基-4-乙基己烷 ,正确的命名是3,5-二甲基-4-乙基己烷 | |
| B. | 涤纶是由对苯二甲酸(PTA)和乙二醇(EG)通过加聚反应得到的 | |
| C. | 有机物CH3CH2CH(CH3)2的一氯代物有4种 | |
| D. | 有机同系物具有相同的通式,且组成相差若干个“CH2”,因此等质量的同系物燃烧耗氧相差物质的量为1.5nmol |
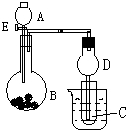 用如图所示装置进行实验,将A逐滴加入B中:
用如图所示装置进行实验,将A逐滴加入B中: 原电池是化学对人类的一个重大贡献.
原电池是化学对人类的一个重大贡献.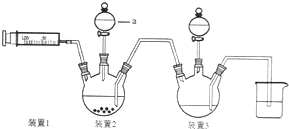 二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g•mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到了人们的关注,它不溶于乙醇,难溶于水.实验室制备二氯化一氯五氨合钴的流程如下,装置如图:
二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g•mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到了人们的关注,它不溶于乙醇,难溶于水.实验室制备二氯化一氯五氨合钴的流程如下,装置如图: