题目内容
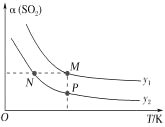
【题目】T1、T2两种温度下BaSO4在水中的沉淀溶解平衡曲线如图所示,请回答下列问题:

(1)T1____(填“>”“<”或“=”)T2,T2时Ksp(BaSO4)=______。
(2)根据T1温度时BaSO4的沉淀溶解平衡曲线,判断下列说法正确的是____(填序号)。
A.加入Na2SO4可由a点变为b点
B.在T1曲线上方区域(不含曲线)的任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能由d点变为T1曲线上a、b之间的某一点(不含a、b)
D.升温可由b点变为d点
(3)沉淀的生成、溶解和转化在无机物制备和提纯及科研等领域有着广泛应用。已知25 ℃时,Ksp(BaSO4)=1×10-10。
①医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸的酸性较强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于胃酸的原因是________(用沉淀溶解平衡原理解释)。万一误服了少量BaCl2,应尽快用大量0.5 mol/L Na2SO4溶液洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为____ mol/L。
②长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为_______________________。
【答案】< ![]() ABC 对于沉淀溶解平衡
ABC 对于沉淀溶解平衡![]() ,
,![]() 不能减少
不能减少![]() 或
或![]() 的浓度,平衡不能向溶解方向移动
的浓度,平衡不能向溶解方向移动 ![]()
![]()
【解析】
(1)沉淀溶解平衡是吸热反应,升高温度,平衡向右移动,即温度越高![]() 的溶解度越大,
的溶解度越大,![]() 温度下的离子积较小,所以
温度下的离子积较小,所以![]() ;
;![]() 时Ksp(BaSO4)=c(Ba2+)c(SO42-)=1.0×10-4mol/L×5.0×10-5mol/L=5.0×10-9mol2/L2;
时Ksp(BaSO4)=c(Ba2+)c(SO42-)=1.0×10-4mol/L×5.0×10-5mol/L=5.0×10-9mol2/L2;
(2)A、由于存在溶解平衡,加入![]() ,
,![]() 浓度增大,
浓度增大,![]() 的沉淀溶解平衡逆向移动,
的沉淀溶解平衡逆向移动,![]() 的浓度降低,a点会变为b点,故正确;
的浓度降低,a点会变为b点,故正确;
B、![]() 曲线上方区域的离子积大于溶度积,所以会析出沉淀,故正确;
曲线上方区域的离子积大于溶度积,所以会析出沉淀,故正确;
C、蒸发溶剂,不饱和溶液中![]() 和
和![]() 的浓度都变大,可能由d点变为
的浓度都变大,可能由d点变为![]() 曲线上a、b之间的某一点,故正确;
曲线上a、b之间的某一点,故正确;
D、升高温度,平衡向沉淀溶解方向移动,c(Ba2+),c(SO42-)会变大,故错误;
故选ABC;
(3)①由沉淀溶解平衡![]() 可知,
可知,![]() 不能减小
不能减小![]() 或
或![]() 的浓度,平衡不能向溶解方向移动;
的浓度,平衡不能向溶解方向移动;
根据Ksp(BaSO4)=c(Ba2+)c(SO42-),c(Ba2+)= Ksp(BaSO4)/ c(SO42-)=![]() =2×10-10mol/L;
=2×10-10mol/L;
②由平衡![]() 可知,加入
可知,加入![]() 溶液后,
溶液后,![]() 与
与![]() 结合生成
结合生成![]() 沉淀
沉淀![]() 浓度减少,使
浓度减少,使![]() 的沉淀溶解平衡向溶解方向移动,发生
的沉淀溶解平衡向溶解方向移动,发生![]() 。
。
故答案为:对于沉淀溶解平衡![]() ,
,![]() 不能减少
不能减少![]() 或
或![]() 的浓度,平衡不能向溶解方向移动;
的浓度,平衡不能向溶解方向移动;![]() ;
;![]() 。
。