题目内容
7.下列实验方案或操作正确的( )| A. | 用饱和Na2CO3 溶液除去CO2中含有的HCl | |
| B. | 往白色ZnS沉淀中滴加CuSO4溶液,沉淀变黑,证明:Ksp(CuS)<Ksp(ZnS) | |
| C. | 进行酸碱中和滴定时,眼睛要注视滴管液面的变化 | |
| D. | 中和热测定实验时,应将NaOH溶液缓慢倒入盐酸中 |
分析 A.二氧化碳、HCl均与碳酸钠反应;
B.发生沉淀的转化,生成更难溶的物质;
C.中和滴定,眼睛观察锥形瓶中颜色的变化;
D.中和热测定反应的最高温度,缓慢倒入盐酸中热量散失.
解答 解:A.二氧化碳、HCl均与碳酸钠反应,不能除杂,应选饱和NaHCO3 溶液除去CO2中含有的HCl,故A错误;
B.发生沉淀的转化,生成更难溶的物质,黑色沉淀为CuS,则Ksp(CuS)<Ksp(ZnS),故B正确;
C.中和滴定,眼睛观察锥形瓶中颜色的变化,不需要注视滴管液面的变化,故C错误;
D.中和热测定反应的最高温度,缓慢倒入盐酸中热量散失,则应迅速一次性将NaOH溶液倒入盐酸中,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、沉淀转化、中和滴定及中和热测定等,把握反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下表中的实验内容不能达到实验目的或不能得出相应实验结论的是( )
| 编号 | 实验内容 | 实验目的或实验结论 |
| ① | 利用一束强光照射矾溶液,产生光亮的“通路”. | 说明明矾一定发生了水解 |
| ② | 向bmL0.1mol/LAgNO3溶液中滴加1mL0.1mol/LNaCl溶液,有白色沉淀生成,再向其中滴加1mL0.1mol/LKI溶液,有黄色沉淀生成. | 验证AgCl的溶解度比AgI大 |
| ③ | 向KI溶液中滴入CuSO4溶液,有白色沉淀生成,但无气体产生,再加入四氧化碳振荡,四氧化碳层呈紫色 | 说明白色沉淀可能为CuI |
| ④ | 室温下,分别向2支试管中加入相同体积,相同浓度的Na2S2O3溶液,再分别加入等体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| ⑤ | 将铁粉投入到盛有稀HNO3的试管中,充分反应后滴入几滴KSCN溶液无明显现象 | 说明HNO3将Fe氧化成Fe2+ |
| A. | ①③ | B. | ③⑤ | C. | ③④ | D. | ②⑤ |
18.下列说法正确的是( )
| A. | 90℃时,纯水的pH等于7 | |
| B. | 配制FeCl3溶液,为了抑制水解,常加稀硫酸 | |
| C. | 已知一种c (H+)=1×10-3mol/L的酸和一种c (OH-)=1×10-3mol/L碱溶液以等体积混合后,溶液呈酸性,其原因是浓的弱酸和稀碱反应所致 | |
| D. | 在Na2S溶液中,离子浓度的关系是:c (Na+)>c (S2-)>c (HS-)>c (OH-)>c (H+) |
2.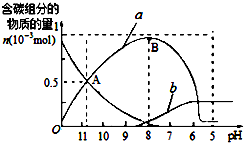 25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
 25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )| A. | Na2CO3溶液中c(Na+)═2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| B. | a、b曲线分别代表的是HCO3-、H2CO3量的变化情况 | |
| C. | A点时:c(Na+)>c(CO32-)═c(HCO3-)>c(H+)>c(OH-) | |
| D. | B点时加入盐酸的体积为10mL,两者恰好完全反应生成NaHCO3 |
12.已知反应:A(g)+B(g)═G(g)+D(g)的能量变化如图所示,下列说法正确的是( )


| A. | 该反应为吸热反应 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 该反应不需要加热就能进行 | |
| D. | 若此反应过程中有电子转移,可设计成原电池 |
19.某有机物A的结构简式如图所示.下列叙述正确的是( )
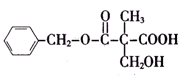

| A. | A不能和新制Cu(OH)2悬浊液反应 | |
| B. | A中含有2种含氧官能团 | |
| C. | A能够发生加成、取代和消去反应 | |
| D. | 1molA和足量的NaOH溶液反应,消耗2molNaOH |
16.研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式.
已知有机物A为饱和多元醇,可由饱和多卤代烃水解得到.为研究A的组成与结构,进行了如下实验:
已知有机物A为饱和多元醇,可由饱和多卤代烃水解得到.为研究A的组成与结构,进行了如下实验:
| 实验步骤 | 解释或实验结论 |
| (1)纯净的A为无色粘稠液体, 易溶于水,沸点为380.4℃ | (1)将A从它的水溶液里分离出来 的操作方法是蒸馏. |
| (2)将13.6gA在20.0L纯O2(过量)中充分燃烧 并使反应后的气体依次缓缓通过浓硫酸和碱石灰后, 测得气体体积分别为17.76L和6.56L (所有气体体积均在标准状况下测定). | (2)A的实验式为C5H12O4, A的分子式为C5H12O4. |
(3)A的核磁共振氢谱如图: | (3)A中含有2种氢原 子,A的键线式为 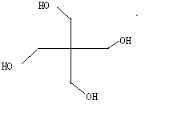 . . |
17.CH4燃料电池应用广泛,以KOH溶液为电解质溶液,使用时电极反应如下:X极:CH4+10OH--8e-═CO32-+7H2O;Y极:4H2O+2O2+8e-═8OH-.下列说法不正确的是( )
| A. | CH4在负极发生氧化反应 | |
| B. | 工作一段时间后,电解质溶液中KOH的物质的量减少 | |
| C. | 在标准状况下,通入5.6LO2完全反应后,有1mol电子发生转移 | |
| D. | 该电池工作时,X极附近溶液的碱性增强 |