题目内容
2.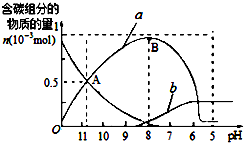 25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )| A. | Na2CO3溶液中c(Na+)═2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| B. | a、b曲线分别代表的是HCO3-、H2CO3量的变化情况 | |
| C. | A点时:c(Na+)>c(CO32-)═c(HCO3-)>c(H+)>c(OH-) | |
| D. | B点时加入盐酸的体积为10mL,两者恰好完全反应生成NaHCO3 |
分析 A.根据物料守恒分析;
B.Na2CO3溶液中逐滴加入HCl先发生反应CO32-+H+=HCO3-,然后发生HCO3-+H+=H2CO3,根据反应结合图象分析;
C.A点时:c(CO32-)和c(HCO3-)相同,溶液显碱性;
D.B点时加入盐酸的体积为10mL,则Na2CO3和HCl的物质的量相同,二者恰好反应.
解答 解:A.Na2CO3溶液中存在物料守恒,即Na元素的总物质的量等于C元素总物质的量的2倍,则c(Na+)═2[c(CO32-)+c(HCO3-)+c(H2CO3)],故A正确;
B.Na2CO3溶液中逐滴加入HCl先发生反应CO32-+H+=HCO3-,然后发生HCO3-+H+=H2CO3,由图象可知a代表的物质逐渐增多,则aHCO3-,b代表的物质开始没有,后来逐渐增多,则b为H2CO3,故B正确;
C.由图象可知,A点时:c(CO32-)和c(HCO3-)相同,溶液显碱性,则c(Na+)>c(CO32-)═c(HCO3-)>c(OH-)>c(H+),故C错误;
D.B点时加入盐酸的体积为10mL,则Na2CO3和HCl的物质的量相同,由CO32-+H+=HCO3-可知,二者恰好反应生成NaHCO3,故D正确.
故选C.
点评 本题考查溶液离子浓度大小比较、离子反应、溶液中守恒关系的应用等问题,题目难度中等,注意分析图象曲线变化趋势,把握物质的性质.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
12.下列实验操作或结论正确的是( )
| A. | 配制一定物质的量浓度的溶液时,将量取液态物质的量筒用水洗涤,洗涤液倒入容量瓶 | |
| B. | 用加热法可以分离KMnO4和碘单质的混合物 | |
| C. | 经氯气消毒的自来水,若用于配制Na2CO3溶液和FeSO4溶液均会使所配溶液变质 | |
| D. | 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 |
13.下列表达方式正确的是( )
| A. | 碳-12原子:612612C | B. | 硫离子结构示意图: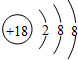 | ||
| C. | 氢氧根的电子式: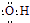 | D. | HClO的结构式:H-O-Cl |
10.下列说法中正确的是( )
| A. | 物质发生化学反应时都伴随着能量变化,伴随能量变化的变化一定是化学变化 | |
| B. | 需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 | |
| D. | 因为3O2═2O3是吸热反应,所以臭氧比氧气更稳定 |
17.镭(Ra)位于周期表的第七周期第ⅡA族,下列关于镭的性质的描述不正确的是( )
| A. | 在化合物中呈+2价 | B. | 单质能与水反应产生氢气 | ||
| C. | 氢氧化物为弱碱 | D. | 碳酸盐难溶于水 |
7.下列实验方案或操作正确的( )
| A. | 用饱和Na2CO3 溶液除去CO2中含有的HCl | |
| B. | 往白色ZnS沉淀中滴加CuSO4溶液,沉淀变黑,证明:Ksp(CuS)<Ksp(ZnS) | |
| C. | 进行酸碱中和滴定时,眼睛要注视滴管液面的变化 | |
| D. | 中和热测定实验时,应将NaOH溶液缓慢倒入盐酸中 |
14.下列各有机物的分类或命名正确的是( )
| A. |  属于芳香烃 属于芳香烃 | B. | CH2=CH-CH=CH2 1,3-二丁烯 | ||
| C. |  3-丁醇 3-丁醇 | D. |  3-甲基-1-丁烯 3-甲基-1-丁烯 |

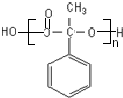 ;
;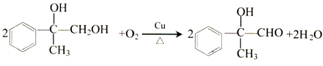 ,
,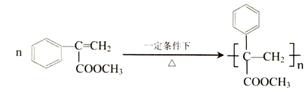 ;
;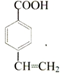 (写结构简式).
(写结构简式). 已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成食品包装材料.
已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成食品包装材料.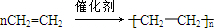 .
.