题目内容
18.下列说法正确的是( )| A. | 90℃时,纯水的pH等于7 | |
| B. | 配制FeCl3溶液,为了抑制水解,常加稀硫酸 | |
| C. | 已知一种c (H+)=1×10-3mol/L的酸和一种c (OH-)=1×10-3mol/L碱溶液以等体积混合后,溶液呈酸性,其原因是浓的弱酸和稀碱反应所致 | |
| D. | 在Na2S溶液中,离子浓度的关系是:c (Na+)>c (S2-)>c (HS-)>c (OH-)>c (H+) |
分析 A.水的电离为吸热过程,升高温度,电离程度增大,溶液中c(H+)增大;
B.两种溶液离子浓度相等,用假设法比较判断;
C.加入硫酸,引入新的杂质;
D.在Na2S溶液中,c(OH-)>c(HS-).
解答 解:A.水的电离为吸热过程,升高温度,电离程度增大,溶液中c(H+)增大,所以90℃时,纯水的pH小于7,故A错误;
B.两种溶液离子浓度相等,如是强酸强碱,则溶液呈中性,如是强酸弱碱混合,则溶液呈碱性,溶液呈酸性,应是酸过量,则应为弱酸,故B正确;
C.加入硫酸,引入新的杂质,为防止水解,应加入盐酸,故C错误;
D.在Na2S溶液中,存在S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-,则c(OH-)>c(HS-),故D错误.故选B.
点评 本题考查盐类的水解以及弱电解质的电子等问题,题目难度中等,本题易错点为B,注意酸碱混合的计算和判断,注意强弱电解质的比较.

练习册系列答案
相关题目
14.下列实验方案中,能测定Na2CO3和NaCl混合物中NaCl质量分数的是( )
| A. | 取a克混合物与足量浓盐酸充分反应,通过排饱和NaHCO3溶液测得生成气体b升(标准状况) | |
| B. | 取a克混合物与足量硝酸银溶液充分反应,过滤、洗涤、烘干,得b克固体 | |
| C. | 取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 | |
| D. | 取a克混合物与足量Ba(OH)2溶液充分反应,过滤,称量得b克固体 |
13.下列表达方式正确的是( )
| A. | 碳-12原子:${\;}_{12}^{6}$C | B. | 硫离子结构示意图: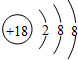 | ||
| C. | 氢氧根的电子式: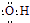 | D. | HClO的结构式:H-O-Cl |
10.下列说法中正确的是( )
| A. | 物质发生化学反应时都伴随着能量变化,伴随能量变化的变化一定是化学变化 | |
| B. | 需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 | |
| D. | 因为3O2═2O3是吸热反应,所以臭氧比氧气更稳定 |
7.下列实验方案或操作正确的( )
| A. | 用饱和Na2CO3 溶液除去CO2中含有的HCl | |
| B. | 往白色ZnS沉淀中滴加CuSO4溶液,沉淀变黑,证明:Ksp(CuS)<Ksp(ZnS) | |
| C. | 进行酸碱中和滴定时,眼睛要注视滴管液面的变化 | |
| D. | 中和热测定实验时,应将NaOH溶液缓慢倒入盐酸中 |
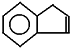 ,茚有一种同分异构体A,A分子中含有一个苯环且只有一个侧链,A有如下转化关系:
,茚有一种同分异构体A,A分子中含有一个苯环且只有一个侧链,A有如下转化关系: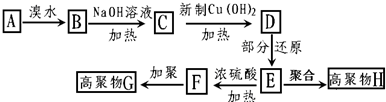
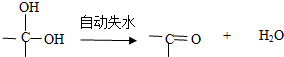
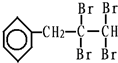 、C的结构简式:
、C的结构简式: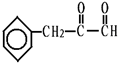
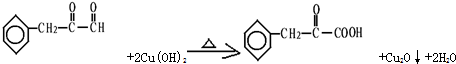

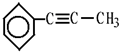
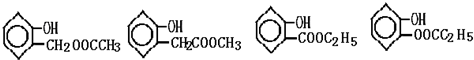 (任写一个)
(任写一个)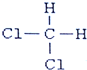 和
和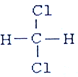
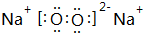 ,Z的化学式SiO2;
,Z的化学式SiO2;