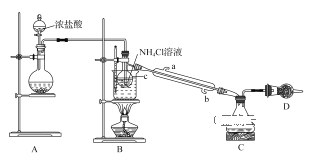
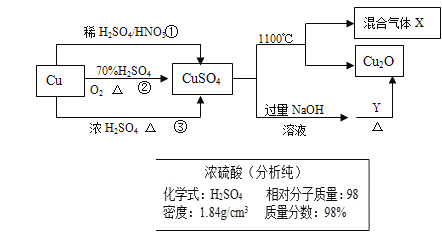
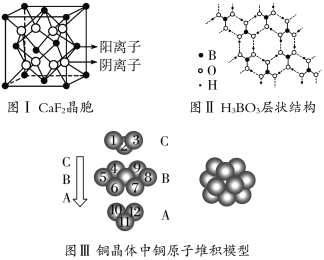
题目内容
【题目】在120 ℃时,将a L乙烯、b L乙烷、c L乙炔(b>c)与d L氧气(过量)混合(a+b+c+d=25),点燃使之充分燃烧后,恢复至原来的温度,所得气体的体积可能是
A. 10 L B. 15 L C. 25 L D. 27 L
【答案】D
【解析】
氧气过量时,根据CxHy+(x+y/4)O2![]() xCO2+y/2H2O
xCO2+y/2H2O
将a L乙烯、完全燃烧需要氧气a(x+y/4)=3aL,生成气体的体积为4aL;b L乙烷完全燃烧需要氧气3.5bL生成气体的体积为5bL、c L乙炔完全燃烧需要氧气2.5cL , 生成气体的体积为3cL,剩余氧气为dL-3aL-3.5bL-1.5L, 充分燃烧后,恢复至原来的温度,所得气体的体积是d-3a-3.5b-2.5c+4a +5b +3c=a+d+1.5b+0.5c= a+b+c+d+0.5b-0.5c=25+0.5(b-c)。因为b>c,所以所得气体的体积大于25L。A.10 L不符合题意,不选;B.15 L不符合题意,不选;C.25 L不符合题意,不选; D.27 L符合题意,故D选;答案:D。

 名校课堂系列答案
名校课堂系列答案【题目】工业上利用N2和H2可以实现合成氨气,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列有关问题:
(1)已知N2(g)+O2(g)=2NO(g) ΔH =+180.5kJ·mol-1,N2(g)+3H2(g)![]() 2NH3(g) ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为___________。
2NH3(g) ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为___________。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g),其化学平衡常数K与温度t的关系如下表:
2NH3(g),其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | ...... |
K/(mol/L)2 | 4.1×106 | K1 | K2 | ...... |
完成下列问题:
①比较K1、K2的大小:K1______K2(填“>”、“=”或“<”);
②在恒温恒压下判断该反应达到化学平衡状态的依据是______(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2) (正)=v(H2) (逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)硝酸工业的尾气NO可用于制备NH4NO3,其工作原理如图。
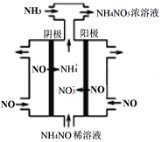
①其阴极的电极反应式为___________。
②常温下,1L pH=6的NH4NO3溶液中c(NH3·H2O)+c(OH-)=________mol·L-1。
(4)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2,反应达到平衡时,c(NH3)=0.5mol·L-1,c(CO2)=0.25mol·L-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3mol NH3,则此时反应的v正____ v逆(填“>”“<”或“=”)。再次平衡后,平衡常数为______。
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2,反应达到平衡时,c(NH3)=0.5mol·L-1,c(CO2)=0.25mol·L-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3mol NH3,则此时反应的v正____ v逆(填“>”“<”或“=”)。再次平衡后,平衡常数为______。