题目内容
【题目】氮元素是一种重要的非金属元素,可形成多种化合物。试回答下列有关问题:
(1)①已知4CO(g)+2NO2(g)4CO2(g)+N2(g) △H=-1200kJmol-1。对于该反应,改变某一反应条件,(已知温度T2>T1)下列图象如图1正确的是___(填代号)。

②已知CO与H2O在一定条件下可以发生反应:CO(g)+H2O(g)CO2(g)+H2(g) △H=-QkJmol-1。820℃时,在甲、乙两个恒容密闭容器中,起始时按照下表进行投料,经过一段时间后达到平衡状态,若甲中CO的转化率为40%,则该反应的平衡常数为___;乙容器吸收的热量为___。
甲 | 乙 |
0.10molH2O | 0.20molH2 |
0.10molCO | 0.20molCO2 |
(2)氨水常用作沉淀剂,已知25℃时,Ksp[Fe(OH)3]=2.6×10-39,Ksp[Al(OH)3]=1.1×10-33,向浓度均为0.1molL-1的FeCl3和AlCl3混合溶液中加入氨水,首先生成的沉淀是___(填化学式)。
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气,已知:
①N2(g)+2O2(g)=N2O4(l) △H=-19.5kJmol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-534.2kJmol-1
写出肼与四氧化二氮反应的热化学方程式___。
(4)纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL0.1molL-1NaOH溶液中加入0.2molL-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图2。

①根据图象写出HN3的电离方程式:___。
②下列说法正确的是___(填序号)。
A.若用已知浓度的NaOH溶液滴定HN3溶液来测定HN3的浓度时应用甲基橙作指示剂
B.常温下,向0.2molL-1HN3的溶液中加水稀释,则![]() 不变
不变
C.分别中和pH均为4的HN3溶液和HCl溶液,消耗0.1molL-1NaOH溶液的体积相同
D.D点时溶液中离子浓度存在如下关系:2c(H+)+c(HN3)=c(N3-)+2c(OH-)
【答案】乙 ![]() 0.12QkJ Fe(OH)3 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △Η=-1048.9kJmol-1 HN3H++N3- BD
0.12QkJ Fe(OH)3 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △Η=-1048.9kJmol-1 HN3H++N3- BD
【解析】
(1)①根据影响化学反应速率的因素:温度、浓度、压强、催化剂来确定化学反应达平衡用到的时间,根据影响化学平衡移动的因素:温度、浓度、压强来确定化学平衡中各个量的变化情况;
②根据化学平衡三段式列式以及化学反应中CO的转化率为40%进行计算即可;
(2)物质的溶度积越小,越易形成沉淀;
(3)依据盖斯定律,结合题干热化学方程式计算写出;
(4)①依据图象可知叠氮酸属于弱酸,据此书写电离方程式即可;
②A.滴定终点时,溶质溶液由酸性变为碱性,据此选择指示剂;
B.依据K只与温度有关进行分析;
C.依据弱酸存在电离进行分析;
D.依据物料守恒和电中性原则计算即可。
![]() 甲:升高温度,化学平衡逆向移动,化学反应速率会迅速增大,会离开原来的速率点,故甲错误;
甲:升高温度,化学平衡逆向移动,化学反应速率会迅速增大,会离开原来的速率点,故甲错误;
乙:升高温度,化学反应速率会迅速增大,所以![]() 时先达到化学平衡状态,并且化学平衡逆向移动,二氧化氮的转化率减小,故乙正确;
时先达到化学平衡状态,并且化学平衡逆向移动,二氧化氮的转化率减小,故乙正确;
丙:对于反应:![]() ,T不变,增大压强,平衡正向移动,一氧化碳的体积分数会减小,故丙错误;
,T不变,增大压强,平衡正向移动,一氧化碳的体积分数会减小,故丙错误;
故答案为乙;
![]() 已知甲中CO的转化率为
已知甲中CO的转化率为![]() ,则有:
,则有:
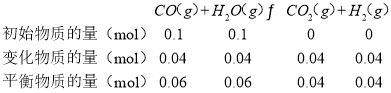
则![]() ,
,
容器乙中:
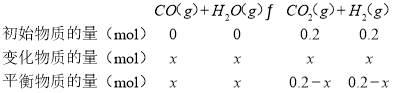
则![]() ,解
,解![]() ,故乙容器吸收的热量为
,故乙容器吸收的热量为![]() ;
;
![]() 根据
根据![]() 、
、![]() 的溶度积常数,在
的溶度积常数,在![]() 下,向浓度均为
下,向浓度均为![]() 的
的![]() 和
和![]() 的混合溶液中逐滴加入氨水,
的混合溶液中逐滴加入氨水,![]() ,加入相同的浓度的氨水,
,加入相同的浓度的氨水,![]() 最先析出;
最先析出;
![]()
![]()
根据盖斯定律写出肼和![]() 反应的热化学方程:
反应的热化学方程:![]() 得到:
得到:![]() ;
;
![]() 依据图象可知叠氮酸属于弱酸,不能完全电离,用可逆号,故电离方程式为:
依据图象可知叠氮酸属于弱酸,不能完全电离,用可逆号,故电离方程式为:![]() ;
;
![]() .滴定终点时,溶质为叠氮酸钠溶液,叠氮酸根离子水解显碱性,溶液由酸性变为碱性,若叠氮酸溶液装在锥形瓶中,应选用酚酞试液作指示剂,故A错误;
.滴定终点时,溶质为叠氮酸钠溶液,叠氮酸根离子水解显碱性,溶液由酸性变为碱性,若叠氮酸溶液装在锥形瓶中,应选用酚酞试液作指示剂,故A错误;
B.常温下,向![]() 的溶液中加水稀释,水的离子积常数不变,电离平衡常数不变,即有:
的溶液中加水稀释,水的离子积常数不变,电离平衡常数不变,即有:![]() ,
,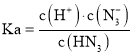 ,故K
,故K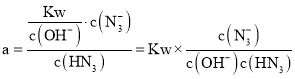 ,Ka不变,Kw不变,故
,Ka不变,Kw不变,故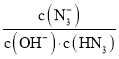 不变,故C正确;
不变,故C正确;
C.pH值相等的盐酸与叠氮酸中已经电离出的氢离子浓度相同,此时消耗氢氧化钠溶液相同,但是由于叠氮酸是弱酸,继续电离出的氢离子还需要氢氧化钠进行中和,故叠氮酸消耗的氢氧化钠的体积大于盐酸消耗的体积,故C错误;
D.![]() 溶液中加入
溶液中加入![]() 的溶液25mL,此时的溶液是叠氮酸钠与叠氮酸为1:1混合,由物料守恒得出:
的溶液25mL,此时的溶液是叠氮酸钠与叠氮酸为1:1混合,由物料守恒得出:![]() ,且溶液中存在电中性原则有:
,且溶液中存在电中性原则有:![]() ,
,![]() 联立,消去钠离子,即可得出:
联立,消去钠离子,即可得出:![]() ,故D正确;
,故D正确;
故答案为BD。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案【题目】Zn是一种应用广泛的金属。用闪锌矿(主要成分为ZnS,还含有SiO2和少量FeS、CdS、PbS、砷化合物杂质等)为原料制备金属Zn和ZnSO4·7H2O的流程如图所示:

①相关金属离子[c(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
回答下列问题:
(1)滤渣1的主要成分除SiO2外还有______,焙烧后产生的气体对环境造成的常见危害为______。
(2)氧化除杂工序中加入ZnO的作用是___________。
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用的试剂为____________。
(4)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为___________。不能省去“还原除杂”步骤,直接在“氧化除杂”步骤中除去Cd2+,理由是________。
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的阳极反应式为_____________;沉积锌后的电解液可返回______工序继续使用。
(6)酸浸液中砷元素以AsO33-存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,写出该反应的离子方程式为___________。