题目内容
某同学从报刊上了解到菠菜中富含可溶性草酸盐和碳酸盐,决定用实验验证这一事实并检测草酸盐含量。进一步查阅资料得知,草酸(H2C2O4)是酸性强于醋酸的二元有机酸,还是一种还原性较强的物质,如2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O,草酸钙(CaC2O4)不溶于水和醋酸,能溶于强酸:CaC2O4+2H+= H2C2O4+Ca2+。
(1)设计实验方案验证菠菜中含有草酸盐和碳酸盐,补充完成实验步骤、预期现象和结论。
限选试剂:1 mol·L-1 H2SO4、1 mol·L-1 HCl、0.1 mol·L-1 NaOH、1 mol·L-1 CaCl2、0.01 mol·L-1 KMnO4、澄清石灰水。
| 实验步骤 | 预期现象和结论 |
| 步骤1:将菠菜研磨后,浸泡、过滤得到澄清待测溶液。 | |
| 步骤2:调节溶液至弱碱性,滴加足量CaCl2溶液。 | 出现白色沉淀,说明菠菜中可能含有草酸盐和碳酸盐。 |
| 步骤3:取步骤2的沉淀于试管中, | |
| 步骤4: | |
(2)要准确测定菠菜中草酸盐含量,请回答有关问题:
① 操作:取m g菠菜样品,将其中草酸盐转化为CaC2O4沉淀分离出来,用盐酸溶解后,将溶液转入_________中加水配制成100mL溶液。每次用_____________移取25.00mL该溶液,用0.0100mol·L-1 KMnO4标准溶液滴定,平均消耗标准溶液V mL。
② 计算:菠菜中草酸盐(以C2O42-计)的质量分数为___________________。(只列式不计算。C2O42-的化学式量为88)
③ 讨论:用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液,结果可能偏高,原因是 。
(16分)(1)(共8分)实验步骤 预期现象和结论 步骤3:加入足量1 mol·L-1 HCl,将产生的气体通入足量澄清石灰水中。(2分) 沉淀溶解,澄清石灰水变浑浊,说明菠菜中含有碳酸盐。(2分) 步骤4: 向步骤3得到的溶液中滴加几滴0.01 mol·L-1 KMnO4。(2分) 溶液紫红色褪去,说明菠菜中含有草酸盐。(2分)
(2)① 100mL容量瓶 酸式滴定管(2分,每种仪器1分)
②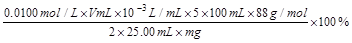 (其它合理表示方法也给分)(4分,算式中不带单位也给分,有效数字不准确扣1分)
(其它合理表示方法也给分)(4分,算式中不带单位也给分,有效数字不准确扣1分)
③ 菠菜中还含有其他还原性物质,能与KMnO4反应(2分)
解析试题分析:(1)依题意,步骤2所得沉淀可能是碳酸钙,也可能是草酸钙,还可能是碳酸钙和草酸钙组成的混合物;由于草酸的酸性比醋酸强,醋酸的酸性比碳酸强,草酸钙不溶于水和醋酸,能溶于强酸,而碳酸钙不溶于水,能溶于醋酸,也能溶于强酸,因此向步骤2所得沉淀中加入足量1 mol·L-1 HCl,若沉淀完全溶解,且产生的气体通入足量澄清石灰水时,澄清石灰水变浑浊,说明沉淀中存在碳酸钙,证明菠菜中含有碳酸盐;由于草酸具有还原性,能使酸性高锰酸钾溶液褪色,即2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O,因此向步骤3所得上层清液中先滴入足量1 mol·L-1 H2SO4,再滴入几滴或少量0.01 mol·L-1 KMnO4,溶液紫红色褪去,说明菠菜中含有草酸盐;(2)①配置100mL一定物质的量浓度的溶液,称量、搅拌溶解后,应将溶液转移入100mL容量瓶中,洗涤之后定容;由于草酸溶液显酸性,所以选用酸式滴定管量取25.00mL草酸溶液;②由于n=c?V,则每次滴定时消耗标准溶液中KMnO4的物质的量为0.0100×V×10-3mol;由于2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O中草酸与高锰酸钾的系数之比等于物质的量之比,则每次滴定时待测溶液中H2C2O4的物质的量为0.0100×V×10-3×5/2mol;由于菠菜样品所配溶液的体积与滴定时待测溶液的体积之比为100/25.00,则菠菜样品所配溶液中H2C2O4的物质的量为0.0100×V×10-3×5/2×100/25.00mol;由于C2O42-~H2C2O4中草酸根离子与草酸的系数之比等于物质的量之比,则菠菜中C2O42-的物质的量为0.0100×V×10-3×5/2×100/25.00×1/1mol;由于草酸根离子的式量为88,m=n?M,则菠菜中C2O42-的质量为0.0100×V×10-3×5/2×100/25.00×1/1×88g;由于菠菜的质量为mg,则菠菜中C2O42-的质量分数为0.0100×V×10-3×5/2×100/25.00×1/1×88/m×100%;③菠菜中不仅草酸盐可以被酸性高锰酸钾溶液氧化,而且别的有机物(如维生素C等)也能被酸性高锰酸钾溶液氧化,因此用标准高锰酸钾溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液,消耗酸性高锰酸钾溶液的体积偏大,因此测定结果偏高。
考点:考查综合实验和化学计算,包括设计检验菠菜中存在碳酸盐和草酸盐的实验方案、选择加入试剂的种类先后及量的多少、预期实验现象和结论、容量瓶的使用、酸式滴定管和碱式滴定管的使用、物质的量在化学方程式计算中的应用、菠菜样品中草酸根离子的质量分数的测定和表示方法、解释误差原因等。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案实验室可以用MgCl2?6H2O为原料制备碳酸镁晶须,主要流程如下:
试回答:
(1)操作1的名称是_______。
(2)上述反应过程要控制好温度,因为MgCO3置于水中长时间加热煮沸可完全生成Mg(OH)2,其原因是_____________________。
(3)另査阅文献,在加热煮沸时也可能生成碱式碳酸镁Mg5(OH)2(CO3)4·4H2O,写出该反应的化学方程式______________。
(4)某课题组为了确定MgCO3在水中长时间加热煮沸后所得的固体成分,进行如下研究。(注:Mg(OH)2, Mg5(OH)2(CO3)4.4H2O在煮沸时均不会分解)
①定性研究:请你完成下表中内容。
| 实验步骤 | 预期的实验现象和结论 |
| 取一定质量的固体样品 | 若 ,则固体产物为Mg(OH)2 |
②另取一定质量的固体,灼烧至恒重,能否通过固体质量的减少量来确定固体的成分?_______ (填“能”或“否”),理由是______________
工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体。
完成下列填空:
(1)气体A中的大气污染物可选用下列试剂中的 (填序号)吸收。
a. 浓H2SO4 b. 浓HNO3 c. NaOH溶液 d. 氨水
(2)用稀H2SO4 浸泡熔渣B,取少量所得溶液,滴加 (填物质名称)溶液后呈红色,说明溶液中存在Fe3+,检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
|

(3)泡铜冶炼粗铜的化学方程式是 。
(4)装置中镁带的作用是 。泡铜和铝粉混合物表面覆盖少量白色固体a,
a是 (填名称)。沙子能否换成水? (填“能”或“不能”)。
(5)用滴定法测定CuSO4·5H2O的含量。取a g试样配成100 mL溶液,取20.00mL用c mol /L 滴定剂(H2Y2–,滴定剂不与杂质反应)滴定至终点,消耗滴定剂bmL,滴定反应:Cu2+ + H2Y2–=CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。
(6)下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中
b.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定
c.滴定前,滴定管尖端有气泡,滴定后气泡消失
实验室用硫酸厂烧渣(主要成分为Fe2O3及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4?7H2O),有关的工艺流程如下:
(1)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是___________(填编号);
| A.品红溶液 | B.紫色石蕊溶液 |
| C.酸性KMnO4溶液 | D.溴水 |
(3)在③中,需加入的物质是___________________________;
(4)在④中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有_______________________;
(5)在⑥中,将溶液Z控制到70~80℃的目的是________________________________;
(6)为测量聚铁样品中铁元素的质量分数,进行下列实验(假设杂质中不含铁元素和硫元素):称取2.700g样品,将样品溶于足量的盐酸后,滴加过量的BaCl2;过滤、洗涤、干燥,称量固体的质量为3.495g。若该聚铁主要成分为[Fe(OH)(SO4)]n,求该聚铁样品中铁元素的质量分数[Mr (BaSO4) =233、Mr (Fe) =56]。(写出计算过程,结果保留4位有效数字)。
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:
(1)指出提取碘的过程中有关实验操作名称 ① ③
(2)写出过程②中有关反应的离子方程式
(3)提取碘的过程中,可供选择的有机试剂是
| A.乙酸 | B.苯 | C.四氯化碳 | D.酒精 |
| 有机试剂 | 酒精 | 四氯化碳 | 苯 | 乙酸 |
| 毒性 | 无 | 无 | 有 | 无 |
| 水溶性 | 与水以任意比互溶 | 与水互不相溶 | 与水互不相溶 | 与水以任意比互溶 |
实验室中某些气体的制取、除杂及收集装置如图所示。仅用此装置和表中提供的物质完成相关实验,最合理的是
| 选项 | a中物质 | b中物质 | c中物质 | d中收集的气体 |
| A | 浓氨水 | CaO | 浓H2SO4 | NH3 |
| B | 浓硫酸 | Na2SO3 | 浓H2SO4 | SO2 |
| C | 饱和食盐水 | 电石 | CuSO4溶液 | CH≡CH |
| D | 浓盐酸 | MnO2 | 饱和NaCl溶液 | Cl2 |






 CH3CH2CH2CHO
CH3CH2CH2CHO CH3CH2CH2CH2OH;CO的制备原理:HCOOH
CH3CH2CH2CH2OH;CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
