题目内容
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:
(1)指出提取碘的过程中有关实验操作名称 ① ③
(2)写出过程②中有关反应的离子方程式
(3)提取碘的过程中,可供选择的有机试剂是
| A.乙酸 | B.苯 | C.四氯化碳 | D.酒精 |
| 有机试剂 | 酒精 | 四氯化碳 | 苯 | 乙酸 |
| 毒性 | 无 | 无 | 有 | 无 |
| 水溶性 | 与水以任意比互溶 | 与水互不相溶 | 与水互不相溶 | 与水以任意比互溶 |
(8分)(1)①过滤 ③ 萃取 (2)Cl2+2I- =I2 + 2Cl-(3)BC。
(以上每空2分,但第(3)小题漏答得1分,多选得0分)
解析试题分析:(1)过滤适用于不溶于水的固体和液体,分离固体和液体采用过滤的方法;将碘水中的碘单质萃取出来,选择合适的萃取剂即可。
(2)过程②是氯气氧化碘离子的过程,反应的离子方程式是Cl2+2I- =I2 + 2Cl-。
(3)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,萃取剂与溶质不反应。碘在四氯化碳或苯中的溶解度大于在水中的溶解度,四氯化碳或苯和水都不互溶,且四氯化碳或苯和碘都不反应,故可用四氯化碳或苯,而乙醇和乙酸与水都是互溶的,不能作为萃取剂,答案选BC。
考点:考查物质的分离和提纯
点评:该题以海水中单质碘的提取为载体,重点考查对常见物质分离与提纯方法的连接掌握情况,有利于调动学生的学习兴趣,激发学生的学习求知欲。旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。掌握过滤、萃取、蒸馏等操作是解答本题的关键。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案某同学从报刊上了解到菠菜中富含可溶性草酸盐和碳酸盐,决定用实验验证这一事实并检测草酸盐含量。进一步查阅资料得知,草酸(H2C2O4)是酸性强于醋酸的二元有机酸,还是一种还原性较强的物质,如2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O,草酸钙(CaC2O4)不溶于水和醋酸,能溶于强酸:CaC2O4+2H+= H2C2O4+Ca2+。
(1)设计实验方案验证菠菜中含有草酸盐和碳酸盐,补充完成实验步骤、预期现象和结论。
限选试剂:1 mol·L-1 H2SO4、1 mol·L-1 HCl、0.1 mol·L-1 NaOH、1 mol·L-1 CaCl2、0.01 mol·L-1 KMnO4、澄清石灰水。
| 实验步骤 | 预期现象和结论 |
| 步骤1:将菠菜研磨后,浸泡、过滤得到澄清待测溶液。 | |
| 步骤2:调节溶液至弱碱性,滴加足量CaCl2溶液。 | 出现白色沉淀,说明菠菜中可能含有草酸盐和碳酸盐。 |
| 步骤3:取步骤2的沉淀于试管中, | |
| 步骤4: | |
(2)要准确测定菠菜中草酸盐含量,请回答有关问题:
① 操作:取m g菠菜样品,将其中草酸盐转化为CaC2O4沉淀分离出来,用盐酸溶解后,将溶液转入_________中加水配制成100mL溶液。每次用_____________移取25.00mL该溶液,用0.0100mol·L-1 KMnO4标准溶液滴定,平均消耗标准溶液V mL。
② 计算:菠菜中草酸盐(以C2O42-计)的质量分数为___________________。(只列式不计算。C2O42-的化学式量为88)
③ 讨论:用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液,结果可能偏高,原因是 。
某工厂废液中含有苯酚、乙酸,实验小组对该废液进行探究,设计如下方案:
己知熔点:乙酸16.6℃、苯酚43℃。沸点:乙酸118℃、苯酚182℃。
(1)写出②的反应化学方程式 。
(2)②中分离B的操作名称是 。
(3)现对物质C的性质进行实验探究,请你帮助实验小组按要求完成实验过程记录,在答题卡上填写出实验操作、预期现象和现象解释。
限选试剂:蒸馏水、稀HNO3、2moL·L—1NaOH、0.1 mol ?L—1KSCN、酸性KMnO4溶 液、FeCl3溶液、饱和溴水、紫色石蕊试液。
| 实验操作 | 预期现象 | 现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,振荡。 | | |
| 步骤2:取少量C的稀溶液分装b、c两支试管,往b试管 | 产生白色沉淀 | |
| 步骤3:往c试管 | | C与加入的试剂发生显色反应。 |
(4)称取一定量的C试样,用水溶解后全部转移至1000mL容量瓶中定容。取此溶液 25.00mL,加入浓度为0.0500 moL·L-1的溴水溶液30.00mL,放置。待反应完全后,加入过量的KI,再用0.1100 moL?L-1Na2S2O3标准溶液滴定生成的I2,耗去Na2S2O3标准溶液11.80mL。则试样中C物质的量的计算表达式为: 。 (部分反应离子方程式:I2+2S2O32—=2I—+S4O62—)
下列有关实验装置进行的相应实验,能达到实验目的的是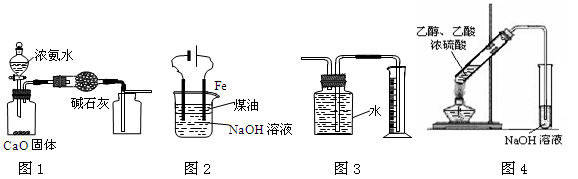
| A.用图1装置制取并收集干燥纯净的NH3 |
| B.用图2装置实验室制备Fe(OH)2 |
| C.装置3收集并测量Cu与浓硝酸反应产生的气体及体积 |
| D.装置4可用于实验室制取乙酸乙酯 |
下图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是
| 选项 | X | 收集气体 | Y |
| A | 碱石灰 | 氯化氢 | 水 |
| B | 碱石灰 | 氨气 | 水 |
| C | 氯化钙 | 二氧化硫 | 氢氧化钠 |
| D | 氯化钙 | 一氧化氮 | 氢氧化钠 |
下列有关实验装置进行的相应实验,能达到实验目的的是( )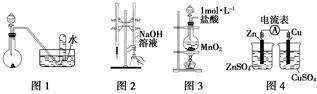
| A.用图1所示装置进行稀硝酸与铜的反应制取并收集NO |
| B.用图2所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验 |
| C.用图3所示装置制取少量Cl2 |
| D.用图4所示装置检验电流的方向 |
实验是化学研究的基础,关于下列各实验装置图的叙述中正确的是( )

① ② ③ ④
| A.装置①:常用于分离互不相溶的液体混合物 |
| B.装置②:可用于吸收NO2或HCl气体,并防止倒吸 |
| C.装置③:先从b口进气集满二氧化碳,再从a口进气,可收集一氧化氮 |
| D.装置④:可用来证明碳的非金属性比硅强 |


