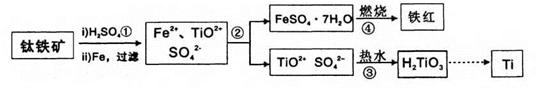
题目内容
工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体。
完成下列填空:
(1)气体A中的大气污染物可选用下列试剂中的 (填序号)吸收。
a. 浓H2SO4 b. 浓HNO3 c. NaOH溶液 d. 氨水
(2)用稀H2SO4 浸泡熔渣B,取少量所得溶液,滴加 (填物质名称)溶液后呈红色,说明溶液中存在Fe3+,检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
|

(3)泡铜冶炼粗铜的化学方程式是 。
(4)装置中镁带的作用是 。泡铜和铝粉混合物表面覆盖少量白色固体a,
a是 (填名称)。沙子能否换成水? (填“能”或“不能”)。
(5)用滴定法测定CuSO4·5H2O的含量。取a g试样配成100 mL溶液,取20.00mL用c mol /L 滴定剂(H2Y2–,滴定剂不与杂质反应)滴定至终点,消耗滴定剂bmL,滴定反应:Cu2+ + H2Y2–=CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。
(6)下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中
b.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定
c.滴定前,滴定管尖端有气泡,滴定后气泡消失
(1)c d (2分)
(2)硫氰化钾 (1分)
另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+(2分)
(3)3Cu2O+2Al 6Cu+ Al2O3 (1分)
6Cu+ Al2O3 (1分)
(4)燃烧放出大量的热,创造高温环境(或引燃剂)(1分) 氯酸钾(1分) 不能(1分)
(5)5bc/4a (2分)
(6)c (1分)
解析试题分析:(1)根据冰铜(mCu2O·nFeS)的组成元素可知,冰铜(mCu2O·nFeS)在空气中燃烧生成的气体A应该是SO2气体。SO2是大气污染物,属于酸性氧化物,因此可用来吸收SO2的试剂是氢氧化钠溶液或氨水。浓硫酸不能吸收SO2,浓硝酸吸收SO2又生成大气污染物NO2,所以正确的答案选cd。
(2)检验铁离子的试剂是KSCN溶液。由于亚铁离子检验还原性,所以检验溶液中还存在亚铁离子的操作是另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+。
(3)根据装置图可知,该反应是铝热反应,化学方程式是3Cu2O+2Al 6Cu+ Al2O3。
6Cu+ Al2O3。
(4)铝热反应需要高温,而镁燃烧可以放出大量的热量,所以镁带的作用是燃烧放出大量的热,创造高温环境(或引燃剂);由于在铝热反应中还需要助燃剂氯酸钾,所以泡铜和铝粉混合物表面覆盖少量白色固体a是氯酸钾。由于铝热反应会放出大量的热量,使生成的金属熔化,如果用水代替沙子,容积击穿坩埚,所以不能用社会代替沙子。
(5)消耗滴定剂的物质的量是0.001bcmol,则根据滴定反应Cu2+ + H2Y2–=CuY2–+ 2H+可知,20.00ml硫酸铜溶液中硫酸铜的物质的量是0.001bcmol,则100ml溶液中硫酸铜的物质的量是0.005bcmol,所以CuSO4·5H2O质量分数的表达式是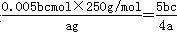 。
。
(6) a.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中,属于正确的操作,结果不影响;b.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定,溶液相当于被稀释,但硫酸铜的物质的量不变,因此结果不变;c.滴定前,滴定管尖端有气泡,滴定后气泡消失,这说明消耗滴定剂的体积增加,因此硫酸铜的物质的量增加,测定结果偏高,答案选c。
考点:考查SO2尾气处理;铁离子以及亚铁离子的检验;铝热反应;滴定反应计算和误差分析

 教材全解字词句篇系列答案
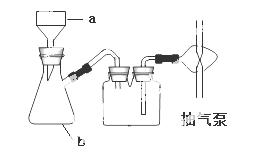
教材全解字词句篇系列答案用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物。(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出。请回答下列问题: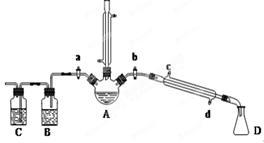
(1)仪器D的名称是 。
(2)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。写出该反应的化学方程式 。
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢等。熄灭A处酒精灯,在竖直冷凝管上方塞上塞子,打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是 、 。
(4)在实验过程中,发现A中液体由无色逐渐变成黑色,该黑色物质与浓硫酸反应的化学方程式为 ,可在竖直冷凝管的上端连接一个内装吸收剂碱石灰的干燥管,以免污染空气。
(5)相关有机物的数据如下:
| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
(6)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g 1-溴丁烷,则1-溴丁烷的产率是 。
下列是实验操作与预期实验目的或所得实验结论,正确的填(√)错误的填(×)
| 选项 | 实验操作 | 实验目的或结论 | 判断 |
| ① | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 说明该钾盐是 | |
| ② | 向某溶液中加入盐酸,无明显现象,再向其中加入BaCl2溶液有白色淀沉淀产生 | 证明该溶液中有 SO42— | |
| ③ | 向淀粉溶液中加入一定量的稀硫酸加热,再加入一定量的新制氢氧化铜加热。 | 证明淀粉水解产生葡萄糖 | |
| ④ |  与浓硫酸170℃共热,制得的气体通人酸性 与浓硫酸170℃共热,制得的气体通人酸性 溶液 溶液 | 检验制得气体是否为乙烯 | |
锶(Sr)为第五周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2?6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如下图: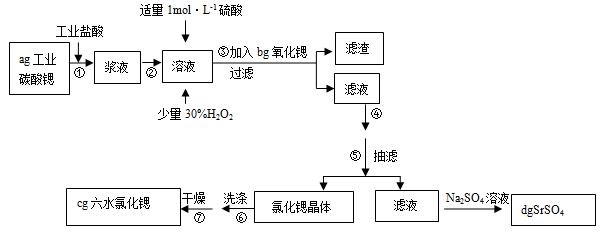
请回答:
(1)加入少量30%H2O2的作用 (用离子方程式表示);
(2)步骤③中氧化锶粉末的作用是 ,工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是 ;
(3)步骤④进行的实验操作为 、 ,步骤⑥中,洗涤氯化锶晶体最好选用 ;
| A.水 | B.硫酸 | C.氢氧化钠溶液 | D.氯化锶饱和溶液 |
(5)计算原工业碳酸锶粉末中碳酸锶的质量分数 (列计算式即可)。
某同学从报刊上了解到菠菜中富含可溶性草酸盐和碳酸盐,决定用实验验证这一事实并检测草酸盐含量。进一步查阅资料得知,草酸(H2C2O4)是酸性强于醋酸的二元有机酸,还是一种还原性较强的物质,如2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O,草酸钙(CaC2O4)不溶于水和醋酸,能溶于强酸:CaC2O4+2H+= H2C2O4+Ca2+。
(1)设计实验方案验证菠菜中含有草酸盐和碳酸盐,补充完成实验步骤、预期现象和结论。
限选试剂:1 mol·L-1 H2SO4、1 mol·L-1 HCl、0.1 mol·L-1 NaOH、1 mol·L-1 CaCl2、0.01 mol·L-1 KMnO4、澄清石灰水。
| 实验步骤 | 预期现象和结论 |
| 步骤1:将菠菜研磨后,浸泡、过滤得到澄清待测溶液。 | |
| 步骤2:调节溶液至弱碱性,滴加足量CaCl2溶液。 | 出现白色沉淀,说明菠菜中可能含有草酸盐和碳酸盐。 |
| 步骤3:取步骤2的沉淀于试管中, | |
| 步骤4: | |
(2)要准确测定菠菜中草酸盐含量,请回答有关问题:
① 操作:取m g菠菜样品,将其中草酸盐转化为CaC2O4沉淀分离出来,用盐酸溶解后,将溶液转入_________中加水配制成100mL溶液。每次用_____________移取25.00mL该溶液,用0.0100mol·L-1 KMnO4标准溶液滴定,平均消耗标准溶液V mL。
② 计算:菠菜中草酸盐(以C2O42-计)的质量分数为___________________。(只列式不计算。C2O42-的化学式量为88)
③ 讨论:用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液,结果可能偏高,原因是 。
某工厂废液中含有苯酚、乙酸,实验小组对该废液进行探究,设计如下方案:
己知熔点:乙酸16.6℃、苯酚43℃。沸点:乙酸118℃、苯酚182℃。
(1)写出②的反应化学方程式 。
(2)②中分离B的操作名称是 。
(3)现对物质C的性质进行实验探究,请你帮助实验小组按要求完成实验过程记录,在答题卡上填写出实验操作、预期现象和现象解释。
限选试剂:蒸馏水、稀HNO3、2moL·L—1NaOH、0.1 mol ?L—1KSCN、酸性KMnO4溶 液、FeCl3溶液、饱和溴水、紫色石蕊试液。
| 实验操作 | 预期现象 | 现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,振荡。 | | |
| 步骤2:取少量C的稀溶液分装b、c两支试管,往b试管 | 产生白色沉淀 | |
| 步骤3:往c试管 | | C与加入的试剂发生显色反应。 |
(4)称取一定量的C试样,用水溶解后全部转移至1000mL容量瓶中定容。取此溶液 25.00mL,加入浓度为0.0500 moL·L-1的溴水溶液30.00mL,放置。待反应完全后,加入过量的KI,再用0.1100 moL?L-1Na2S2O3标准溶液滴定生成的I2,耗去Na2S2O3标准溶液11.80mL。则试样中C物质的量的计算表达式为: 。 (部分反应离子方程式:I2+2S2O32—=2I—+S4O62—)
下列有关实验装置进行的相应实验,能达到实验目的的是( )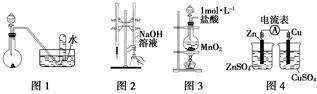
| A.用图1所示装置进行稀硝酸与铜的反应制取并收集NO |
| B.用图2所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验 |
| C.用图3所示装置制取少量Cl2 |
| D.用图4所示装置检验电流的方向 |