题目内容
【题目】A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
A | ||||||
B | C[ | D | ||||
E | F | G | H | |||
请回答下列问题:
(1)写出E元素在周期表中的位置 。
(2)B与D可形成三原子分子X,X的电子式为 。
(3)E、F、H所形成的简单离子的半径由大到小的顺序为 (用离子符号表示)。
(4)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(5)由A、C、D三种元素组成的强电解质Z溶于水时能促进水的电离,测得Z的水溶液pH<7,其原因是 (用离子方程式来表示)。
(6)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如图所示。
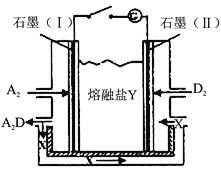
写出石墨(I)电极上发生的电极反应式 。
(7)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为 。
【答案】(1)第三周期第IA族
(2)![]()
(3)r(S2-)>r(Na+)>r(Al3+)
(4)SiO2+2C高温 Si+2CO↑
(5)NH4+ + H2O![]() NH3·H2O+H+
NH3·H2O+H+
(6)H2+![]() -2e-=H2O+CO2
-2e-=H2O+CO2
(7)0.4mol
【解析】试题解析:A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,由元素再周期表中位置,可知A为H元素;B为碳元素,C为N元素;D为O元素;E为Na,F为Al;G为Si;H为S元素。
(1)E为钠元素,它在周期表中的位置是第三周期第IA族。
(2)B与D形成的三原子分子X是CO2,其电子式为![]() 。
。
(3)电子层结构相同的离子,核电荷数越大离子半径越小,电子层数越多离子半径越大,故离子半径:S2-
>Na+>Al3+。
(4)G的最高价氧化物为SiO2,与B的单质(碳)在高温下能发生置换反应,其化学反应方程式为:SiO2+2C
![]() Si+2CO↑。
Si+2CO↑。
(5)由H、N、O三种元素组成的强电解质Z溶于水时能促进水的电离,测得Z的水溶液pH<7,则Z为
NH4NO3,溶液中由于铵根离子水解使溶液呈酸性:NH4++H2ONH3H2O+H+。
(6)盐Y由C、O、Na组成,则Y为Na2CO3,以熔融盐Na2CO3为电解质、氢气、氧气构成的燃料电池,
由图可知石墨(I)是氢气失去电子,与碳酸根离子结合生成水与二氧化碳,电极反应式:H2+![]() -2e-=
-2e-=
H2O+CO2。
(7)电解发生反应:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,2H2O
2Cu+O2↑+2H2SO4,2H2O![]() 2H2↑+O2↑,相当于从溶液中析出
2H2↑+O2↑,相当于从溶液中析出
CuO、失去部分水,向溶液中加入0.1mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,将Cu(OH)2
可以改写为CuOH2O,电解中生成Cu为0.1mol,2H2O![]() 2H2↑+O2↑中电解的水为0.1mol,整个
2H2↑+O2↑中电解的水为0.1mol,整个
过程转移电子为0.1mol×2+0.1mol×2=0.4mol。

【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:

沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是 。调pH步骤中加入的试剂最好是 (填化学式)。实验室进行过滤操作所用到的玻璃仪器有 、 、 。
(2)煮沸CuSO4溶液的原因是 。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式 。
(3)Fe3+发生水解反应Fe3++3H2O![]() Fe(OH)3+3H+,该反应的平衡常数表达式为 。
Fe(OH)3+3H+,该反应的平衡常数表达式为 。
(4)称取所制备的CuCl样品0.250 0 g置于一定量的0.5 mol·L-1FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.100 0 mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00 mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数 。