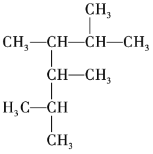
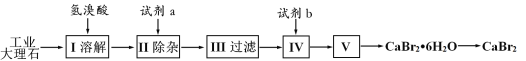
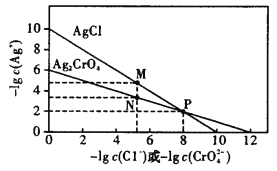
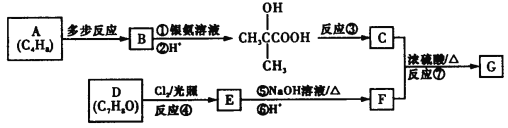
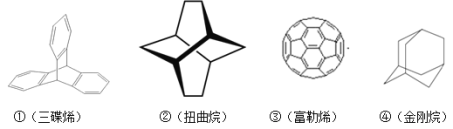
题目内容
【题目】某小组进行如图实验。欲使溶液红色加深,下列操作或分析正确的是

A.加入少量KCl固体
B.再滴加5~6滴1 mol/L KSCN溶液
C.再滴加3~5滴0.01 mol/L NaOH溶液
D.对溶液降温,也可观察到溶液红色加深,说明反应为:FeCl3+3KSCN![]() Fe(SCN)3+3KCl△H>0
Fe(SCN)3+3KCl△H>0
【答案】B
【解析】
A项、KSCN溶液与FeCl3溶液反应的离子方程式为Fe3++3SCN—![]() Fe(SCN)3,加入少量KCl固体,溶液中Fe3+和SCN—的浓度不变,平衡不移动,溶液红色不变,故A错误;
Fe(SCN)3,加入少量KCl固体,溶液中Fe3+和SCN—的浓度不变,平衡不移动,溶液红色不变,故A错误;
B项、KSCN溶液与FeCl3溶液反应的离子方程式为Fe3++3SCN—![]() Fe(SCN)3,再滴加5~6滴1 mol/L KSCN溶液,溶液中SCN—的浓度增大,平衡向正反应方向移动,Fe(SCN)3的浓度增大,溶液红色加深,故B正确;
Fe(SCN)3,再滴加5~6滴1 mol/L KSCN溶液,溶液中SCN—的浓度增大,平衡向正反应方向移动,Fe(SCN)3的浓度增大,溶液红色加深,故B正确;
C项、KSCN溶液与FeCl3溶液反应的离子方程式为Fe3++3SCN—![]() Fe(SCN)3,再滴加3~5滴0.01 mol/L NaOH溶液,氯化铁溶液与氢氧化钠溶液反应,溶液中Fe3+的浓度减小,平衡向逆反应方向移动,Fe(SCN)3的浓度减小,溶液红色变浅,故C错误;
Fe(SCN)3,再滴加3~5滴0.01 mol/L NaOH溶液,氯化铁溶液与氢氧化钠溶液反应,溶液中Fe3+的浓度减小,平衡向逆反应方向移动,Fe(SCN)3的浓度减小,溶液红色变浅,故C错误;
D项、KSCN溶液与FeCl3溶液反应的离子方程式为Fe3++3SCN—![]() Fe(SCN)3,对溶液降温,也可观察到溶液红色加深,说明平衡向正反应方向移动,△H<0,故D错误;
Fe(SCN)3,对溶液降温,也可观察到溶液红色加深,说明平衡向正反应方向移动,△H<0,故D错误;
故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目