题目内容
【题目】(1)浓度均为0.01 mol·L-1的8种溶液:①HNO3 ②H2SO4 ③CH3COOH ④Ba(OH)2 ⑤NaOH
⑥CH3COONa ⑦KCl ⑧NH4Cl,这些溶液pH由小到大的顺序是(填写编号)_________。
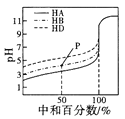
(2)pH=2的某酸HnA(An+为酸根)与pH=12的某碱B(OH)m混合,恰好反应生成正盐,混合液pH=8。
①反应生成的正盐的化学式为________。
②该盐中____离子一定能水解,其第一步水解的离子方程式为____________。
【答案】②①③⑧⑦⑥⑤④ BnAm An- An-+H2O![]() HA(n-1)-+OH
HA(n-1)-+OH
【解析】
(1)先将物质的按照碱、盐、酸的顺序分类,再根据盐的水解和弱电解质的电离特点比较PH,再按照溶液的PH由大到小进行排序;
(2)pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合生成正盐,说明酸中氢离子的总物质的量和碱中氢氧根离子的总物质的量相等,其盐溶液呈碱性,说明碱的电离程度大于酸的电离程度,根据化合物中化合价的代数和为0确定其化学式,根据酸碱的相对强弱确定水解的离子。
(1)属于碱的为:④Ba(OH)2⑤NaOH,浓度相同时,碱性④>⑤;
水解呈碱性的为:⑥CH3COONa,但水解程度较小,则pH:④>⑤>⑥;
溶液呈中性的为:⑦KCl;
溶液呈酸性的有:①②③⑧,其中①为一元强酸,②为二元强酸,③为弱酸,⑧水解呈酸性,浓度相同时,
溶液的pH:②<①<③<⑧,
综合以上分析可知,溶液的pH由大到小的顺序是为:④⑤⑥⑦⑧③①②,
故答案为:④⑤⑥⑦⑧③①②;
(2)①HnA中A的化合价是n价,B(OH)m中B的化合价是+m价,根据化合物中化合价的代数和为0知,二者的离子个数之比为n:m,则其化学式为:BnAm,
故答案为:BnAm;
②根据题意知,其正盐溶液呈碱性,说明碱的电离程度大于酸的电离程度,生成的盐是强碱弱酸盐,则An离子一定能水解,其水解方程式为:An+H2OHA(n1)+OH,
故答案为:An; An+H2OHA(n1)+OH。

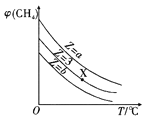
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下: 2CH4(g) ![]() C2H4(g) +2H2(g) ΔH>0
C2H4(g) +2H2(g) ΔH>0
化学键 | H—H | C—H | C = C | C—C |
E(kJ / mol) | a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=___________ (用含a.b.c.d的代数式表示)。
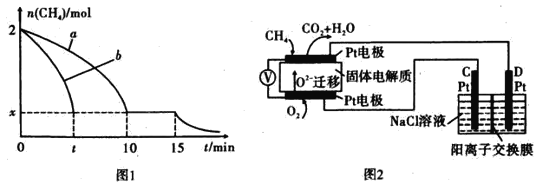
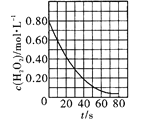
(2)T1温度时,向1 L的恒容反应器中充入2 molCH4 ,仅发生上述反应,反应过程中 0~15 min CH4的物质的量随时间变化如图1所示,测得10-15 min时H2的浓度为1.6 mol/L。
①0~ 10 min内CH4表示的反应速率为____mol/(Lmin) o
②若图中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (CH4)变化曲线,其中表示催化剂表面积较大的曲线是 ________ (填"a"或 “b”)。
③15 min时,若改变外界反应条件,导致n( CH4)发生图中所示变化,则改变的条件可能是_____(任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4).c2(H2) 其中K正、K逆为速率常数仅与温度有关,T1温度时k正与K逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数V正 ____V逆(填“>”“=”或“<”),判断的理由是__________
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-
①C极的Pt为_______ 极(选填“阳”或“阴” )。
②该电池工作时负极反应方程式为_____________________ 。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112 mL,则阴极区所得溶液c(OH—)=_______ (假设电解前后溶液的体积均为500 mL)。