题目内容
【题目】根据下列各图曲线表征的信息,得出的结论不正确的是( )
A.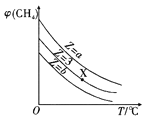 表示一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)
表示一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)平衡时φ(CH4)的体积分数与Z(Z=
CO(g)+3H2(g)平衡时φ(CH4)的体积分数与Z(Z=![]() )和T(温度)的关系,则该反应的焓变△H>0,且b>3>a
)和T(温度)的关系,则该反应的焓变△H>0,且b>3>a
B.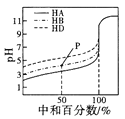 表示室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线,可以看出三种酸的电离常数关系为KHA>KHB>KHD,且滴定至P点时,溶液中:c(HB)>c(Na+)>c(B- )>c(H+)>c(OH-)
表示室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线,可以看出三种酸的电离常数关系为KHA>KHB>KHD,且滴定至P点时,溶液中:c(HB)>c(Na+)>c(B- )>c(H+)>c(OH-)
C.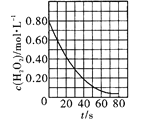 是室温下H2O2催化分解放出氧气的反应中c(H2O2)随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
是室温下H2O2催化分解放出氧气的反应中c(H2O2)随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
D.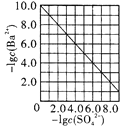 是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+)与c(SO42-)的关系曲线,说明溶液中c(SO42-)越大c(Ba2+)越小
是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+)与c(SO42-)的关系曲线,说明溶液中c(SO42-)越大c(Ba2+)越小
【答案】B
【解析】
A.升高温度,甲烷的体积分数减小,说明升高温度平衡正向移动,则该反应的焓变△H>0;起始![]() =Z,Z越小,说明甲烷相对越多,达到平衡时甲烷的含量越多,则Z的大小为a<3<b,故A正确;
=Z,Z越小,说明甲烷相对越多,达到平衡时甲烷的含量越多,则Z的大小为a<3<b,故A正确;
B.相同物质的量浓度的一元酸,酸的pH越小,氢离子浓度越大,说明酸的电离程度越大,则该酸的酸性越强,其电离平衡常数越大,根据图知,未加NaOH溶液时,pH:HA<HB<HD,说明酸的电离程度HA>HB>HD,则KHA>KHB>KHD;中和50%即P点,溶液中溶质为等物质的量浓度的酸(HB)和盐(NaB),由图可知溶液呈酸性,则c(H+)>c(OH-),且酸的电离程度大于酸根离子水解程度;①NaB完全电离:NaB=Na++B-,这一步的c(B-)=c(Na+),②HB少部分电离:HBH++B-,则c(HB)>c(H+),③NaB少部分水解:B-+H2OHB+OH-,由于酸的电离程度大于盐的水解程度,则HB电离产生的B-相对NaB水解消耗的B-多,所以c(B-)>c(Na+),由于HB电离消耗得多,水解生成的HB少,所以c(Na+)>c(HB),则c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),故B错误;
C.反应物浓度越大,反应速率越大,根据图知,随着时间的进行,双氧水浓度逐渐降低,则随着反应的进行H2O2分解速率逐渐减小,故C正确;
D.温度不变,溶度积常数不变,Ksp(BaSO4)=c(Ba2+)·c(SO42-),c(Ba2+)与c(SO42-)成反比,则c(SO42-)越大c(Ba2+)越小,故D正确;
故答案为B。

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】现有如下3个热化学方程式:
H2(g)+![]() O2(g)=H2O(g) ΔH1= -a kJ·mol-1①
O2(g)=H2O(g) ΔH1= -a kJ·mol-1①
H2(g)+![]() O2(g)=H2O(l) ΔH2= -b kJ·mol-1②
O2(g)=H2O(l) ΔH2= -b kJ·mol-1②
2H2(g)+O2(g)=2H2O(l) ΔH3= -c kJ·mol-1③
则由下表所列的原因能推导出后面结论的是( )
选项 | 原因 | 结论 |
A | H2的燃烧是放热反应 | a、b、c均大于零 |
B | ①和②中物质的化学计量数均相同 | a=b |
C | ①和③中H2O的状态不同,化学计量数不同 | a、c不会有任何关系 |
D | ③的化学计量数是②的2倍 | ΔH2<ΔH3 |
A.AB.BC.CD.D
【题目】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+2B2(g)![]() 2AB3(g) ΔH<0,相关数据如下表所示:
2AB3(g) ΔH<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1mol A2、2molB2 | 2molAB3 | 2mol AB3 |
反应物的转化率 | a甲 | a乙 | a丙 |
反应的平衡常数K= | K甲 | K乙 | K丙 |
平衡时AB3的浓度/mol·L-1 | c甲 | c乙 | c丙 |
平衡时AB3的反应速率/mol·L-1·min-1 | v甲 | v乙 | v丙 |
下列说法正确的是( )
A.v甲=v丙B.c乙<c丙C.a甲 +a乙<1D.K乙