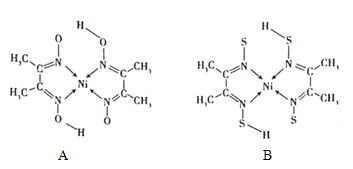
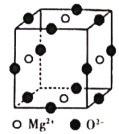
题目内容
【题目】下列有关热化学方程式的叙述正确的是( )
A.已知甲烷的燃烧热为![]() ,则甲烷燃烧的热化学方程式可表示为
,则甲烷燃烧的热化学方程式可表示为![]()
![]()
B.已知![]() 石墨,
石墨,![]() 金刚石,
金刚石,![]() ,则金刚石比石墨稳定
,则金刚石比石墨稳定
C.已知中和热为![]()
![]() ,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热
,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热
D.已知![]() ;
;![]() ,则
,则![]()
【答案】D
【解析】
A.已知甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═2CO2(g)+2H2O(l)△H=890.3kJ/mol,故A错误;
B.已知C(石墨,s)═C(金刚石,s)△H>0,说明石墨的能量较低,石墨比金刚石稳定,故B错误;
C.1mol稀硫酸和足量稀NaOH溶液反应生成2mol水,反应热为2×57.3kJ/mol,故C错误;
D. 气态硫的能量大于固态硫,因此气态硫燃烧生成二氧化硫时放出的热量多,放出的热量越多,焓变越小,因此△H1<△H2,故D正确;
所以本题答案选D。

【题目】有些特殊的钢中含有Fe、C、Mn、V等元素,其中Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如下表:
元素 | Mn | Fe | |
电离能(kJ/mol) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
回答下列问题:
(1)Mn元素基态原子的价电子排布图为________。比较锰和铁两元素的电离能I2和I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是:________________。
(2)钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1。分子中采取sp2杂化的原子有_________,1mol分子中含有配位键的数目是_____。
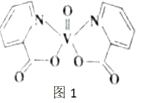
(3)铁元素广泛应用,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成黄血盐,其配离子结构如图![]() 离子所带电荷未标出
离子所带电荷未标出![]() 。
。
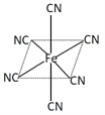
①已知CN-与N2结构相似,CN-的电子式是___________。
②化合物Fe(CO)5熔点为253K,沸点为376K,其固体属于____晶体。
③写出沉淀溶解的化学方程式_______________________________。
④图2的甲是Fe的一种晶胞,晶胞中Fe的堆积方式为___________,己知该晶体的密度为ρg/cm3用NA表示阿伏加德罗常数的值,则该晶胞的边长为___________cm。
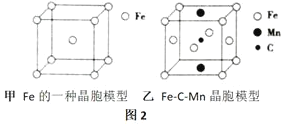
⑤图2的乙是Fe-C-Mn合金(晶体有缺陷)的一种晶胞,则与C原子等距紧邻Fe的个数为____________,该合金的化学式为___________。
【题目】现有如下3个热化学方程式:
H2(g)+![]() O2(g)=H2O(g) ΔH1= -a kJ·mol-1①
O2(g)=H2O(g) ΔH1= -a kJ·mol-1①
H2(g)+![]() O2(g)=H2O(l) ΔH2= -b kJ·mol-1②
O2(g)=H2O(l) ΔH2= -b kJ·mol-1②
2H2(g)+O2(g)=2H2O(l) ΔH3= -c kJ·mol-1③
则由下表所列的原因能推导出后面结论的是( )
选项 | 原因 | 结论 |
A | H2的燃烧是放热反应 | a、b、c均大于零 |
B | ①和②中物质的化学计量数均相同 | a=b |
C | ①和③中H2O的状态不同,化学计量数不同 | a、c不会有任何关系 |
D | ③的化学计量数是②的2倍 | ΔH2<ΔH3 |
A.AB.BC.CD.D